Формы существования a–аминокислот
в зависимости от реакции среды.
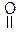
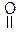 Наличие двух функциональных групп – кислотного (СООН–) и основного (NH2–) характера обуславливает амфотерность a–аминокислот. Между ОН– кислотным центром (к.ц.) карбоксильной группы и основным центром (о.ц.) группы –NH2 по донорно-акцепторному механизму идет образование диполярного иона (цвиттер–иона).
Наличие двух функциональных групп – кислотного (СООН–) и основного (NH2–) характера обуславливает амфотерность a–аминокислот. Между ОН– кислотным центром (к.ц.) карбоксильной группы и основным центром (о.ц.) группы –NH2 по донорно-акцепторному механизму идет образование диполярного иона (цвиттер–иона).




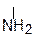
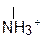
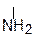 R – CH – C – OH R – CH – C – O– + H+ R – CH – COO–
R – CH – C – OH R – CH – C – O– + H+ R – CH – COO–
 |
 к.ц. диссоциирует по типу
к.ц. диссоциирует по типу
о.ц. слабого электролита о.ц. акцептор
донор диполярный ион
 В водном растворе a–аминокислота существует в виде равновесной смеси диполярного иона, катионной и анионной форм. Положение равновесия зависит от pH среды. Общим для всех a–аминокислот является преобладание катионных форм в сильнокислых (рН~1) и анионных – в сильнощелочных (рН~11) средах.
В водном растворе a–аминокислота существует в виде равновесной смеси диполярного иона, катионной и анионной форм. Положение равновесия зависит от pH среды. Общим для всех a–аминокислот является преобладание катионных форм в сильнокислых (рН~1) и анионных – в сильнощелочных (рН~11) средах.
– Н+ – Н+
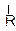
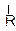
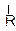


 NH3+ – CH – COOH NH3+ – CH – COO– NH2 – CH – COO–
NH3+ – CH – COOH NH3+ – CH – COO– NH2 – CH – COO–
+ Н+ + Н+
Катионная форма Диполярный ион Анионная форма

 (рН~1,0) Сильнокислая среда рН~7,0 Сильнощелочная среда (рН~11,0)
(рН~1,0) Сильнокислая среда рН~7,0 Сильнощелочная среда (рН~11,0)
Значение рН, при котором суммарный заряд молекулы a–аминокислоты (белка) равен 0, называется изоэлектрической точкой (pI), а состояние a–аминокислоты (белка) – изоэлектрическим.
Дата добавления: 2015-08-11; просмотров: 1199;
