Измерение э.д.с. химических источников тока.
Для измерения э.д.с. гальванических элементов и аккумуляторов. Используют высокоомные вольтметры (с большим внутренним сопротивлением) для того, чтобы величина тока была минимальной I = U/R. Если пи измерении э.д.с. идет ток, то величина разности потенциалов уменьшается и не соответствует э.д.с.
Химические источники электрической энергии (ХИЭЭ)
ХИЭЭ –устройства для прямого превращения химической энергии окислительно-восстановительных реакций в электрическую. Существуют три типа источников тока: ГЭ, топливные элементы и аккумуляторы.
ГЭ относятся к первичным элементам, т.е. устройствам, которые допускают лишь однократное использование активных материалов электродов. В процессе работы регенерация (обновление) реагентов и самих электродов не происходит. Это источники энергии однократного использования (в быту мы их называем «батарейки»). Один из первых ГЭ – это элемент Даниеля –Якоби:
Zn|ZnSO4||CuSO4|Сu.
Анод (окисление): Zn → Zn2+ + 2e
Kатод (восстан-е): Cu2+ + 2e → Cu
При замыкании внешней цепи через систему пойдет электрический ток до тех пор, пока на электродах будут идти процессы обмена с передачей электронов, обусловленные различными электродными потенциалы цинка и меди. Электродный потенциал цинка меньше, чем меди, поэтому в процессах обмена цинк будет окисляться, отдавая два электрона, которые будут использоваться для восстановления катионов меди до металлического состояния. Электрод, на котором протекает процесс окисления называется анодом, а электрод-металл, на котором протекает процесс восстановления – катодом. В схеме электрической цепи металл-анод (более электроотрицательный) записывают слева, а металл-катод (более электроположительный) – справа. ЭДС этого элемента составляет DЕ = 0, 34 –(-0,76) = 1,1В.
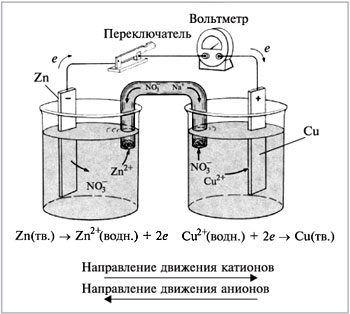
Рис. 3. Электрохимическая цепь или гальванический элемент
Марганцево-цинковый элемент, также известный как элемент Лекланше — это первичный химический источник тока, в котором анодом является цинковый стаканчик (корпус батарейки) с герметичным уплотнением из полимерных материалов. Катодом – графитовый стержень, помещенный в смесь диоксида марганца с измельченным графитом. В качестве электролита (ионного проводника) используется пастообразная смесь хлоридов аммония и цинка. Это один из самых широко распространенных ГЭ (DЕ = 1,25-1,5В). Используется в переносных устройствах для питания радиоприемников, часов, игрушек и пр. Он очень удобен в эксплуатации, т.к. его составные части твердые или пастообразные. Изначально элементы заполнялись жидким электролитом. В дальнейшем электролит стали загущать с помощью крахмалистых веществ — это позволяло сделать более практичные элементы питания, называемые сухими, в которых сведена к минимуму возможность вытекания электролита.
Схема ГЭ: Zn|NH4Cl, ZnCl2|MnO2(C)
Процессы на электродах:
Анод: Zn → Zn2+ + 2e
Катод: MnO2 + NH4+ + e → MnOOH + NH3 или MnO2 + Н2О+ e → MnOOH + ОН-
или метагидороксид марганца (III)
Суммарный процесс: Zn + 2MnO2 +2Н2О+ e → Zn2+ + 2MnOOH + 2ОН-. Далее образуется гидроксид цинка: Zn2+ + ОН- = Zn(ОН)2. Хлорид аммония вводится для того, чтобы препятствовать процессу образования гидроксида цинка, затрудняющего анодный процесс, образуя растворимую комплексную соль:
2Zn(ОН)2 + 4NH4Cl = [Zn(NH3)4]Cl2 + 4Н2О + ZnCl2
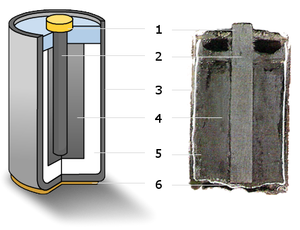

Марганцево-цинковый элемент.
(1) — металлической колпачок,
(2) — графитовый электрод («+»),
(3) — цинковый стакан («—»),
(4) — оксид марганца,
(5) — электролит,
(6) — металлический контакт.
Топливный элемент (ТЭ) –первичный (неперезаряжаемый) химический источник тока (ХИТ), в котором происходит непрерывное возмещение расходуемых реагентов и непрерывное удаление образующихся продуктов.
Появление первых ТЭ – это реализация идеи прыямого превращения энергии сгорания горючих веществ в электрическую. Применение топливных элементов для этой цели позволяет получить К.П.Д., близкий к 100%. В то время как сжигание топлива в современной теплоэлектростанции дает КПД 20%, максимум 40%.
Принцип действия. Топливный элемент (рис. 1) состоит из двух электродов, разделенных электролитом, и систем подвода топлива (водорода и кислодрода) на электроды, а также системы для удаления продуктов реакции. В большинстве случаев для ускорения химической реакции используются катализаторы. Внешней электрической цепью топливный элемент соединен с нагрузкой, которая потребляет электроэнергию.
Есть типы ТЭ щелочные и кислотные, но суммарная ОВР у них одна: 2Н2 + О2 = 2Н2О. Электроды в ТЭ – индефферентные, т.е. не принимающие участие в электродных процессах. Их изготавливают из графита с добавками платины и металлов платиновой группы, также применяют электроды из серебра, никеля, спеченные оксидные электроды.
В изображенном на рисунке топливном элементе с кислым электролитом водород подается через полый анод и поступает в электролит через очень мелкие поры в материале электрода. При этом происходит разложение молекул водорода на атомы, которые в результате хемосорбции, отдавая каждый по одному электрону, превращаются в положительно заряженные ионы. Этот процесс может быть описан следующими уравнениями:
В кислотных ТЭ протекают реакции:
Анод: Н2 ® 2Н+ + 2e Ix2
Катод: О2 + 4Н+ + 4e ® 2Н2О
2Н2(газ) + О2(газ) ® 2Н2О(жид)
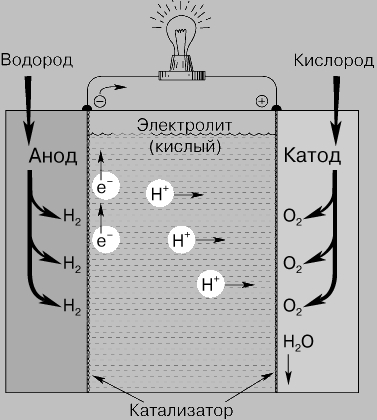
Рис. 1. ВОДОРОДНО-КИСЛОРОДНЫЙ ТОПЛИВНЫЙ ЭЛЕМЕНТ. Эти элементы непрерывно снабжаются кислородом и водородом для получения электрической энергии в результате постоянно поддерживающейся химической реакции.
Наиболее распространенным является щелочной ТЭ. Газообразные водород и кислород пропускают через пористые угольные электроды в концентрированном растворе щелочи:
Анод: 2Н2 + 4ОН- → 4Н2О + 4e
Катод: О2 + 2Н2О + 4e ® 4ОН-
2Н2(газ) + О2(газ) ® 2Н2О(жид)
Образующаяся в результате реакции вода частично разбавляет электролит. В любом топливном элементе часть энергии химической реакции превращается в тепло. Поток электронов во внешней цепи представляет собой постоянный ток, который используется для совершения работы. Большинство реакций в топливных элементах обеспечивают ЭДС около 1,0 – 1,2 В. Размыкание цепи или прекращение движения ионов останавливает работу топливного элемента. Процесс, происходящий в водородно-кислородном топливном элементе, по своей природе является обратным хорошо известному процессу электролиза, в котором происходит диссоциация воды при прохождении через электролит электрического тока. Действительно, в некоторых типах топливных элементов процесс может быть обращен - приложив к электродам напряжение, можно разложить воду на водород и кислород, которые могут быть собраны на электродах. Если прекратить зарядку элемента и подключить к нему нагрузку, такой регенеративный топливный элемент сразу начнет работать в своем нормальном режиме. Теоретически размеры топливного элемента могут быть сколь угодно большими. Однако на практике несколько элементов объединяются в небольшие модули или батареи, которые соединяются либо последовательно, либо параллельно.
Типы топливных элементов. Существуют различные типы топливных элементов. Их можно классифицировать, например, по используемому топливу, рабочему давлению и температуре, по характеру применения. Есть топливные элементы. Где вместо водорода используют гидразин
N2H2 + O2 = N2 + 2Н2О
Применение:Поскольку в процессе работы ТЭ образуется вода, которую можно использовать в качестве питьевой, например, на космических кораблях, где применяют системы из топливных элементов в качестве источника энергии. В недалеком будущем топливные элементы могут стать широко используемым источником энергии на транспорте, в промышленности и домашнем хозяйстве. Пока высокая стоимость топливных элементов ограничивает их применение военными и космическими приложениями. Предполагаемые применения топливных элементов включают их применение в качестве переносных источников энергии для армейских нужд и компактных альтернативных источников энергии для околоземных спутников с солнечными батареями при прохождении ими протяженных теневых участков орбиты. Небольшие размеры и масса топливных элементов позволили использовать их при пилотируемых полетах к Луне. Топливные элементы на борту трехместных кораблей "Аполлон" применялись для питания бортовых компьютеров и систем радиосвязи. Топливные элементы можно использовать в качестве источников питания оборудования в удаленных районах, для внедорожных транспортных средств, например в строительстве. В сочетании с электродвигателем постоянного тока топливный элемент будет эффективным источником движущей силы автомобиля. Для широкого применения топливных элементов необходимы значительный технологический прогресс, снижение их стоимости и возможность эффективного использования дешевого топлива. При выполнении этих условий топливные элементы сделают электрическую и механическую энергию широко доступными во всем мире.
Дата добавления: 2015-08-11; просмотров: 1446;
