После устранения перегородки начнется самодиффузия
Теперь предположим, что по разные стороны перегородки находится один и тот же газ. После устранения перегородки начнется самодиффузия. С одной стороны, ясно, что устранение перегородки ничего не изменяет в состоянии газа, две части которого объединяются в одну систему. Поэтому в результате устранения перегородки энтропия системы не меняется.
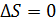 .
.
Формулировка парадокса
Возрастание энтропии, вызванное смешением разного рода газов при постоянных температурах и давлениях, не зависит oт природы этих газов (пока они разные, подчеркивал Гиббс!), в то время как смешение двух масс одного и того же газа не вызывает возрастания энтропии. Таким образом, при переходе от смеси сколь угодно близких по своим свойствам газов к смеси одинаковых газов изменение энтропии испытывает скачок
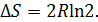
В этом скачке энтропии смешения и состоит парадокс Гиббса.
Разрешение парадокса
Парадокс находит своё разрешение в квантовой физике. Число различных типов атомов конечно, поэтому нельзя выполнить предельный переход, в котором бы свойства одного атома переходили в свойства другого.
11.6. Изменение энтропии в процессах самоорганизации открытых систем
В первой лекции нашего курса мы анонсировали «загадку» самоорганизации в открытых системах, находящихся вдали от термодинамического равновесия. Отметим, что возникновение упорядоченной структуры однозначно приводит к уменьшению энтропии в той локальной области пространства, где она формируется. Однако, этот процесс «обязан» сопровождаться компенсацией – возрастанием энтропии в окружающей среде

Если суммарное изменение энтропии оказывается меньше нуля, то процесс самоорганизации не идёт, или если шёл, то прекратится. По этому принципу идут или не идут химические реакции, возникают звёзды, галактики и их скопления, образуются белковые молекулы, живые организмы и вообще все уровни организации живых систем, включая биосферу. Заведите маленького котёнка и вы увидите, что неравенство (11.12) выполняется.
Закон возрастания энтропии в открытой системе нашел свое отражение в трех биогеохимических принципах В.И. Вернадского, основоположника учения о биосфере. Кратко эти принципы можно сформулировать так:
• Биогенная миграция химических элементов в биосфере всегда стремится к максимальному значению.
• Эволюция видов, приводящая к формам жизни, устойчивым в биосфере, идёт в направлении, увеличивающем биогенную миграцию химических элементов.
• В течение всего геологического времени заселение планеты живыми организмами должно быть максимально возможным.
Проанализируйте принципы Вернадского и убедитесь, что они «вырастают» из неравенства (11.12).
Контрольные вопросы
1. Что называется вечным двигателем второго рода?
2. Какие процессы запрещает второе начало термодинамики?
3. Можно ли работу полностью превратить в теплоту (без компенсации)? Приведите пример.
4. Передайте содержание первой части энтропийной формулировки второго начала.
5. Передайте содержание второй части энтропийной формулировки второго начала.
6. Что означает рост энтропии в изолированной системе?
7. Выведите закон возрастания энтропии.
8. В чем заключается парадокс «демона Максвелла» и как он разрешается?
9. Как проявляется статистический характер второго начала термодинамики?
10. Каким образом следует вычислять изменение энтропии для необратимых процессов? Поясните на примере процесса Гей-Люссака.
11. В чем заключается парадокс Гиббса?
12. Как изменяется энтропия в процессах самоорганизации открытых систем? Проанализируйте принципы Вернадского а рамках энтропийного подхода.
ЛЕКЦИЯ 12
ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ И УСЛОВИЯ РАВНОВЕСИЯ
Предыдущая лекция была посвящена изучению различных процессов в макросистемах с помощью такой функции состояния как энтропия. Наряду с энтропией для этих целей можно использовать и другие, связанные с ней функции состояния. Функции состояния называются также термодинамическими функциями или термодинамическими потенциалами. Термодинамических функций можно произвести бесконечное множество. Если известна одна из них, то любая функция от этой функции также является термодинамической функцией, разумеется, при выполнении условий (8.2) и (8.3). В научной практике из этого многообразия функций получили распространение только четыре. Прежде чем назвать их, запишем равенство, именуемое основным термодинамическим тождеством для обратимых процессов. Оно объединяет первое начало термодинамики и определение энтропии для обратимых процессов. Из (11.1) следует, что 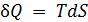 и уравнение первого начала обретает новую содержательную форму
и уравнение первого начала обретает новую содержательную форму

Во всех обратимых (равновесных) процессах это равенство тождественно выполняется. Для неравновесных процессов выполняется основное неравенство термодинамики: 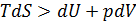 .
.
12.1. Термодинамические функции
Назовём четыре общеупотребительные термодинамические функции: внутренняя энергия, энтальпия, свободная энергия, термодинамический потенциал Гиббса. Каждая из них может быть представлена, как функция любых двух переменных из 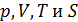 . Энтропия в качестве независимой переменной вводится с помощью термодинамического тождества (12.1). Кроме того, термическое уравнение состояния связывает параметры
. Энтропия в качестве независимой переменной вводится с помощью термодинамического тождества (12.1). Кроме того, термическое уравнение состояния связывает параметры  . Поэтому получается, что только два параметра из четырех могут быть независимыми.
. Поэтому получается, что только два параметра из четырех могут быть независимыми.
Свободная энергия
Выразим элементарную работу из уравнения (12.1).
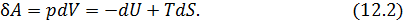
Если процесс изотермический  , то производимая системой работа может быть представлена в виде
, то производимая системой работа может быть представлена в виде
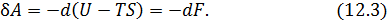
Как видим бесконечно малая работа, совершаемая системой при изотермическом процессе, является полным дифференциалом и равна взятому с обратным знаком изменению свободной энергии 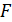 . Таким образом свободная энергия определяется как
. Таким образом свободная энергия определяется как

При изотермических процессах свободная энергия играет такую же роль, как и внутренняя энергия при адиабатных процессах. Величина 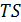 называется связанной энергией. Свободную энергию называют также функцией Гельмгольца или энергией Гельмгольца, поскольку именно этот ученый ввел ее в термодинамическую теорию.
называется связанной энергией. Свободную энергию называют также функцией Гельмгольца или энергией Гельмгольца, поскольку именно этот ученый ввел ее в термодинамическую теорию.
Термодинамический потенциал Гиббса
Эта функция имеет широкое применение для описания различных процессов, особенно в термодинамике фазовых превращений. Потенциал Гиббса или энергию Гиббса можно определить следующими способами:

Внутренняя энергия
Внутренняя энергия определяется первым началом термодинамики, но её можно выразить через другие термодинамические потенциалы:

Энтальпия (тепловая функция)
Напомним, что энтальпия – это такая функция состояния, приращение которой в квазистатическом процессе при постоянном давлении даёт количество теплоты 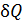 , полученное системой (см. схему 9.2.1).
, полученное системой (см. схему 9.2.1).
Соответственно энтальпия определяется как

Энтальпию называют также тепловой функцией.
Канонические уравнения состояния
Если функции состояния представлены как функции определённых двух макропараметров, а именно:
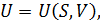

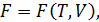

то такие равенства называются каноническими уравнениями состояния системы. Каноническое уравнение состояния в любой из четырёх форм (12.8) содержит полные сведения о термических и калорических свойствах вещества. По этой причине оно является мощным инструментом для проведения полного термодинамического анализа макросистем.
12.2. Метод термодинамических потенциалов. Соотношения Максвелла.
Метод термодинамических потенциалов был развит Гиббсом. Этот метод заключается в использовании свойства полного дифференциала термодинамической функции, что позволяет получить уравнения, необходимые для анализа того или иного явления. На схеме 12.2.1 представлены выражения для полных дифференциалов четырех термодинамических потенциалов и полученные на их основе двенадцать уравнений, четыре из которых, а именно, равенства между производными, называются соотношениями Максвелла.
Поясним способ нахождения дифференциальных соотношений (12.13) –(12.15) из выражения для полного дифференциала 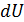 . Итак, соотношение (12.13) получается из (12.9) при условии, что
. Итак, соотношение (12.13) получается из (12.9) при условии, что 
 . Соотношение (12.14) выводится из (12.9), если
. Соотношение (12.14) выводится из (12.9), если 
 . Наконец, равенство (12.15) является следствием вычисления смешанной производной в (12.13) и (12.14) и приравнивания левых частей полученных уравнений.
. Наконец, равенство (12.15) является следствием вычисления смешанной производной в (12.13) и (12.14) и приравнивания левых частей полученных уравнений.
Схема 12.2.1.
Двенадцать уравнений метода термодинамических потенциалов


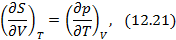
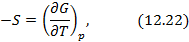

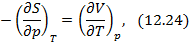
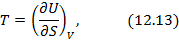

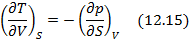


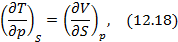
Полные дифференциалы термодинамических потенциалов
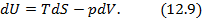
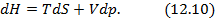

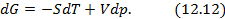
Полученные двенадцать уравнений – это своеобразная «таблица умножения» в термодинамике. Правда её не надо запоминать, надо знать, что она существует. Используя эти соотношения, можно получить множество полезных уравнений термодинамики. На схеме 12.2.2 представлены некоторые наиболее популярные формулы, полученные с помощью соотношений (12.13)-(12.24).
Схема 12.2.2.
Дифференциальные формулы для проведения термодинамического анализа макросистем

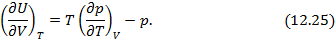
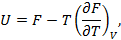
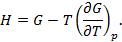


Уравнения
Гиббса-Гельмгольца

12.3. Условия термодинамической устойчивости макроскопических систем. Принцип Ле Шателье-Брауна
Теория термодинамического равновесия была развита Гиббсом путём обобщения и распространения принципа виртуальных перемещений на термодинамические системы. Рассмотрение этой теории выходит за рамки нашего курса. Ограничимся констатацией и обсуждением её основных результатов. На схемах 12.3.1, 12.3.2 и 12.3.3 представлены различные критерии термодинамической устойчивости макросистем, полученные в рамках теории Гиббса.
Схема 12.3.1.
Основной критерий термодинамической устойчивости изолированной системы
При устойчивом равновесии изолированной системы энтропия максимальна по отношению ко всем вариациям, при которых объём и внутренняя энергия системы остаются постоянными.


Схема 12.3.2.
| Критерии устойчивости состояний термодинамической системы в различных процессах |
| Условия протекания процесса |
| Макропарметры, сохраняющие свои постоянные значения |
| Система находится в теплоизолирующей оболочке |

|
| Система находится в термостате |
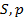
|

|
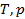
|
 - внутренняя энергия, - внутренняя энергия,
|
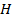 - энтальпия, - энтальпия,
|
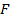 - свободная энергия, - свободная энергия,
|
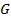 – энергия Гиббса. – энергия Гиббса.
|
| При устойчивом состоянии системы минимальное значение принимает один из термодинамических потенциалов |
Схема 12.3.3.
Частные условия устойчивости равновесия химически однородных систем

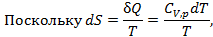 cледовательно
cледовательно

Термическая устойчивость

Механическая устойчивость
Условия термической устойчивости отражают тот факт, что теплоёмкости 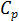 и
и  в устойчивых состояниях не могут быть отрицательными. Механическая устойчивость требует, чтобы давление и объём изменялись антибатно, то есть они не могут одновременно возрастать или убывать в изотермических и адиабатных процессах.
в устойчивых состояниях не могут быть отрицательными. Механическая устойчивость требует, чтобы давление и объём изменялись антибатно, то есть они не могут одновременно возрастать или убывать в изотермических и адиабатных процессах.
Принцип Ле Шателье-Брауна
Общее условие устойчивости равновесия термодинамических систем находят свое отражение в принципе, установленном французским ученым Ле Шателье в 1884 году и обоснованном немецким физиком Браунов в 1887 году. Принцип Ле Шателье-Брауна позволяет предсказать направление процесса в системе, когда она выведена внешним воздействием из состояния равновесия. Принцип гласит:
Если на систему, находящуюся в состоянии устойчивого термодинамического равновесия, воздействуют внешние факторы, стремящиеся вывести ее из этого состояния, то в системе возникают процессы, направленные на уничтожение изменений, вызываемых внешними воздействиями.
Этот принцип оказывается очень полезным для понимания таких процессов как, электростатическая и электромагнитная индукции в проводниках, теплопроводность и электропроводность в различных средах и многих других.
Отметим, что необходимым условием применимости принципа Ле Шателье-Брауна является устойчивость начального состояния системы. Принцип не применим к процессам, переводящим систему в более устойчивое состояние, например к взрывам.
Проведение полного термодинамического анализа вещества на полуэмпирической основе
Формулы, представленные в 12.1-12.3, позволяют описать все термодинамические свойства вещества, если речь идёт о чистых веществах. Какую информацию необходимо привлечь из эксперимента?
1. Следует установить экспериментально термическое уравнение состояния 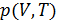 , если, конечно, оно не получено теоретически методами молекулярной статистики. Последнее не всегда возможно.
, если, конечно, оно не получено теоретически методами молекулярной статистики. Последнее не всегда возможно.
2. Необходимы данные о теплоёмкостях 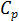 и
и  , дополненные формулой (12.26).
, дополненные формулой (12.26).
Эта информация позволяет полностью описать количественно все термодинамические характеристики вещества. Теперь, надеюсь, вам становится ясно, почему так многочисленны и разнообразны существующие методики определения теплоёмкостей. Некоторые из них представлены в лабораторных задачах физического практикума по молекулярной физике данного курса.
12.4. Третье начало термодинамики
В начале ХХ века немецким учёным Вольтером Фридрихом Германом Нернстом были проведены экспериментальные исследования физико-химических свойств ряда веществ при низких температурах. В частности им был решён вопрос об изменении энтропии в окрестности абсолютного нуля температур. Из термодинамического определения энтропии  не очевидно, будет этот интеграл сходиться или нет при
не очевидно, будет этот интеграл сходиться или нет при 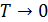 . Всё зависит от поведения
. Всё зависит от поведения 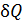 вблизи абсолютного нуля. Обобщая свои эмпирические исследования, Нернст пришёл к выводу, что интеграл сходится. Этот вывод был им сформулирован в 1906 году в так называемой тепловой теореме или третьем начале термодинамики. Современную расширенную формулировку третьего начала в редакции Макса Планка часто называют теоремой Нернста–Планка.
вблизи абсолютного нуля. Обобщая свои эмпирические исследования, Нернст пришёл к выводу, что интеграл сходится. Этот вывод был им сформулирован в 1906 году в так называемой тепловой теореме или третьем начале термодинамики. Современную расширенную формулировку третьего начала в редакции Макса Планка часто называют теоремой Нернста–Планка.
Формулировка постулата
При приближении всякой равновесной макроскопической системы к абсолютному нулю температур приращение энтропии 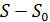 стремится к вполне определённому конечному пределу, не зависящему от значений, которые принимают все параметры, характеризующие систему (давление, объём и пр.).
стремится к вполне определённому конечному пределу, не зависящему от значений, которые принимают все параметры, характеризующие систему (давление, объём и пр.).
Математическая запись постулата (варианты)
• Если 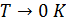 , то
, то 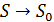 .
.
• Интеграл вида  сходится, при
сходится, при 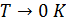 .
.
•  где
где  – любой термодинамический параметр.
– любой термодинамический параметр.
Информационное содержание постулата
•Стремление энтропии к определенному пределу в окрестности абсолютного нуля температур влечет за собой целый ряд следствий, относящихся к поведению термодинамических величин в низкотемпературной области. Пять следствий третьего начала термодинамики выделены далее в отдельный список.
•Нижний предел энтропии одинаков для всех систем, поэтому его можно принять равным нулю в классической физике, и он получается «на кончике пера» равным нулю в квантовой теории. Применение квантовых моделей материального тела всегда приводит к тому, что теплоёмкость системы при низких температурах зависит от температуры и притом, не линейно, а более сильно. Это гарантирует сходимость интеграла к нулю.
•Содержание теоремы относится только к равновесным состояниям системы. К неравновесным и метастабильным состояниям она не применима. Существуют вещества, такие, как стёкла, некоторые сплавы, глицерин,  ,
,  и другие, для которых
и другие, для которых  при
при 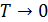 стремится к отличной от нуля величине. Это происходит потому, что эти вещества пребывают в долгосрочных метастабильных состояниях. Проходят дни, недели, годы, даже десятки и сотни лет пока подобные системы приблизятся к равновесным состояниям.
стремится к отличной от нуля величине. Это происходит потому, что эти вещества пребывают в долгосрочных метастабильных состояниях. Проходят дни, недели, годы, даже десятки и сотни лет пока подобные системы приблизятся к равновесным состояниям.
Статус постулата
Третий постулат, в отличие от предшествующих постулатов, не вводит новых функций состояния, но устанавливает неформальное начало отсчёта энтропии как нижний её предел. Третье начало имеет статус постулата только в классической физике. В квантовой теории стремление энтропии к нулю в окрестности абсолютного нуля температур получается «автоматически». Теорема Нернста-Планка имеет доказательство в квантовой теории, которое не может быть истолковано классически.
Следствия третьего начала
Следствие 1. Абсолютный нуль температур недостижим за конечное число шагов. Это следствие по своему содержанию эквивалентно третьему началу в формулировке Планка (подробнее см. в [1]).
Следствие 2. При приближении к абсолютному нулю температур теплоёмкость стремится к нулю:

Только в этом случае интегралы 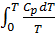 и
и 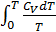 сходятся.
сходятся.
Следствие 3.При приближении к абсолютному нулю температур термические коэффициенты объёмного расширения и давления стремятся к нулю:

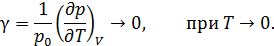
Такое поведение коэффициентов не совместимо с уравнением состояния классического идеального газа, это следствие доказывается с помощью соотношений Максвелла (12.21) и (12.24).
Следствие 4. В окрестности абсолютного нуля температур газ не описывается уравнением Клапейрона-Менделеева, даже если силы взаимодействия между молекулами сколь угодно малы
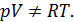
Следствие 5.В окрестности абсолютного нуля температур внутренняя энергия газа не является функцией температуры, а является функцией его плотности
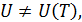

Следствия 3, 4 и 5 фиксируют факт того, что газ находится в состоянии вырождения, ему соответствует модель идеального квантового газа.
Обсуждением третьего начала и его следствий мы заканчиваем рассмотрение основ термодинамики. Надеюсь, вы теперь достаточно подготовлены, чтобы приступить к изучению явлений в реальных молекулярных системах.
Контрольные вопросы
1. Какое равенство называется основным термодинамическим тождеством? Запишите его. Для каких процессов оно выполняется?
2. Дайте определение термодинамической функции, называемой свободной энергией.
3. Дайте определение термодинамическому потенциалу Гиббса.
4. Как внутренняя энергия выражается а) через энергию Гельмгольца;
б) через энтальпию?
5. Как энтальпия выражается а) через внутреннюю энергию;
б) через энергию Гиббса?
6. Какие уравнения называются каноническими уравнениями состояния системы? Какова особенность этих уравнений?
7. Каким образом можно получить двенадцать дифференциальных уравнений метода термодинамических потенциалов? Какие их этих уравнений называются соотношениями Максвелла?
8. Сформулируйте основной критерий термодинамической устойчивости изолированной системы.
9. Какие условия обеспечивают химически однородной системе а) термическую устойчивость; б) механическую устойчивость.
10. Какое утверждение содержит в себе принцип Ле Шателье-Брауна? Какова область применимости этого принципа? Приведите примеры.
11. Сформулируйте третье начало термодинамики в редакции М.Планка. Определите статус этого постулата.
12. Проанализируйте пять следствий третьего начала термодинамики.
III. ФИЗИКА РЕАЛЬНЫХ МАКРОСИСТЕМ
ЛЕКЦИЯ 13
РЕАЛЬНЫЕ МАКРОСИСТЕМЫ
Изучение реальных макросистем, т.е. систем с межмолекулярным взаимодействием, начнем с рассмотрения свойств вещества в состоянии термодинамического равновесия, а затем перейдем к анализу процессов в неравновесных системах.
Как вам известно, вещества могут существовать в четырех агрегатных состояниях. Исключим пока из рассмотрения такое состояние вещества как плазма. Забудем про неё до изучения ядерной физики. В ближайшей перспективе сконцентрируем своё внимание на свойствах таких систем как реальный газ, жидкость и твердое тело, а также на их взаимных превращениях. Последние принято называть фазовыми превращениями или фазовыми переходами. Теперь самое время сформулировать определение фазы.
Фазой называется макроскопическая физически однородная часть вещества, отделенная от остальных частей системы границами раздела. Например, вода, лед и пар; вода, ртуть и смесь паров воды, ртути и воздуха; графит и алмаз. Из приведенных примеров и вашего повседневного опыта ясно, что в системе может быть несколько твердых или жидких фаз, но не более одной газообразной, поскольку газы необратимо смешиваются между собой. Прежде чем углубиться в тему фазовых переходов обратимся к моделям материальных тел, разберемся с внутренней структурой вещества в различных агрегатных состояниях. Определяющим фактором в реальных системах являются силы межмолекулярного взаимодействия.
На больших расстояниях молекулы притягиваются друг к другу, а на малых расстояниях порядка размеров самых молекул частицы отталкиваются друг от друга. По своей природе силы межмолекулярного взаимодействия являются электрическими. В зависимости от распределения электронной плотности внутри отдельных молекул и концентрации самих молекул в пространстве существуют различные типы межмолекулярного взаимодействия. Для каждого агрегатного состояния характерны свои типы взаимодействия.
Количественным критерием существования того или иного агрегатного состояния вещества может служить соотношение средней кинетической энергии молекулы  и энергии межмолекулярного притяжения
и энергии межмолекулярного притяжения 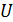 . Заметим, что энергия притяжения - величина отрицательная (знак « - »), а кинетическая энергия – положительная (знак «+»), поэтому сравнивать будем не значения, а модули этих энергий. Итак, если
. Заметим, что энергия притяжения - величина отрицательная (знак « - »), а кинетическая энергия – положительная (знак «+»), поэтому сравнивать будем не значения, а модули этих энергий. Итак, если



Дадим более детальное описание каждого из этих состояний и начнем с твердого тела.
13.1. Твердые тела
В физике твердыми телами обычно называются только кристаллические тела. Аморфные тела типа воска, стекла, пластика, хотя они и могут быть твердыми (сохранять свою форму), рассматриваются как очень вязкие жидкости. Аморфные тела не имеют определенной температуры плавления. При нагревании они постепенно размягчаются, их вязкость при этом уменьшается, и они превращаются в жидкость. Аморфные тела изотропны, т.е. их свойства одинаковы по всем направлениям.
Кристаллические тела имеют определенную температуру плавления при фиксированном давлении. Свойства кристаллов неодинаковы по различным направлениям. Кристаллы анизотропны. Скорость распространения света, коэффициенты теплопроводности и упругости и многие другие свойства кристалла зависят от направления в нем. Это связано с особенностями внутреннего строения твердого тела.
Условие (13.3) свидетельствует о том, что в кристалле силы межатомного притяжения доминируют, существенно подавляя хаотическое движение атомов. Поступательное движение сведено на нет и возможны только небольшие тепловые колебания атомов около положения равновесия. Устойчивое равновесие достигается при вполне определенном расположении молекул относительно друг друга. Поскольку такое распределение составляющих кристалл элементов должно происходить по всему объему тела, то неизбежно периодическое повторение формы, т.е. возникновение кристаллической решетки с определенной симметрией. Точки равновесного положения атомов, ионов и молекул в кристалле называют узлами кристаллической решетки. Под симметрией понимается способность твердого тела совмещаться с самим собой в результате реальных или воображаемых действий над его точками.
Операциями симметрии называются действия, с помощью которых производится совмещение тела. Такими операциями являются отражение, повороты, инверсии и трансляции (параллельные переносы). В частности, если решетка совмещается сама с собой при мысленном повороте вокруг некоторой оси на угол 360º, где 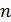 – число совмещений за полный оборот, то эту ось называют осью симметрии n-го порядка. В твердых телах имеют место только оси симметрии с порядками 2, 3, 4 и 6 с соответствующими углами поворота 180, 120, 90 и 60º. Симметрия 5-го порядка в кристаллах невозможна.
– число совмещений за полный оборот, то эту ось называют осью симметрии n-го порядка. В твердых телах имеют место только оси симметрии с порядками 2, 3, 4 и 6 с соответствующими углами поворота 180, 120, 90 и 60º. Симметрия 5-го порядка в кристаллах невозможна.
В основе теории твердого тела лежит модель бесконечного совершенного монокристалла. Если выбрать начало координат в некотором узле кристаллической решетки, то радиус-вектор любого другого узла можно представить в виде

где 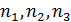 – целые числа, включая ноль. Векторы
– целые числа, включая ноль. Векторы  называются базисными, а их совокупность базисом решетки. Сам вектор
называются базисными, а их совокупность базисом решетки. Сам вектор  называется вектором трансляции. Длины векторов
называется вектором трансляции. Длины векторов  называются основными периодами (параметрами) решетки. Параллелепипед с ребрами
называются основными периодами (параметрами) решетки. Параллелепипед с ребрами  вместе с атомами в его вершинах, а возможно и внутри объёма параллелепипеда, называется элементарной ячейкой трансляцией этой ячейки создаётся бесконечная пространственная решетка. Если ячейка содержит восемь атомов в вершинах параллелепипеда и не одного атома внутри своего объёма, то ячейка называется примитивной. Сложные ячейки имеют узлы внутри своего объёма или на гранях параллелепипеда.
вместе с атомами в его вершинах, а возможно и внутри объёма параллелепипеда, называется элементарной ячейкой трансляцией этой ячейки создаётся бесконечная пространственная решетка. Если ячейка содержит восемь атомов в вершинах параллелепипеда и не одного атома внутри своего объёма, то ячейка называется примитивной. Сложные ячейки имеют узлы внутри своего объёма или на гранях параллелепипеда.
Конкретная кристаллическая решетка может быть представлена не одной решеткой Браве, а совокупностью нескольких решеток Браве. В таких случаях она называется сложной решеткой.
Выбор базиса даже примитивной решетки не является однозначным. На рис. 13.1 приведены примеры примитивных (а, б) и сложных (в, г) ячеек для одного и того же кристалла (двухмерная решётка).
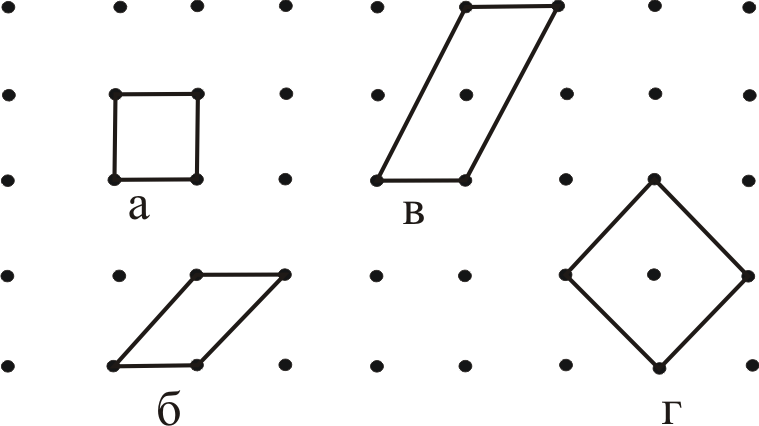
Рис. 13.1.
Наименьшая из примитивных ячеек, включающая в себя все элементы симметрии решетки, называется ячейкой или параллелепипедом Браве. Существует всего семь типов решеток или семь типов кристаллических систем. Характеристики кристаллических систем и их названия приведены в табл. 13.1.
Таблица. 13.1.
| Кристаллическая система | Соотношение рёбер элементарной ячейки | Соотношение между углами в элементарной ячейке |
| Триклинная | 
| 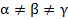
|
| Моноклинная | 
| 
|
| Ромбическая | 
| 
|
| Тетрагональная | 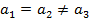
| 
|
| Кубическая | 
| 
|
| Ромбоэдрическая | 
| 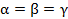 но но 
|
| Гексагональная | 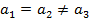
| 
|
Ограничимся вышеизложенными представлениями о симметрии кристаллов, хотя они, безусловно, не исчерпывают затронутую тему. Последовательно и подробно эти вопросы изучаются в курсе кристаллографии.
Теперь уместно обратиться к рассмотрению межатомных взаимодействий в твердых телах. Минимизация энергии взаимодействия приводит к той или иной симметрии кристалла и определенному типу пространственной решетки. Положительная разность между энергией изолированных атомов и энергией атомов в кристаллической решетке называется энергией связи  . Ее значение колеблется в интервале 0,1÷ 7,0 эВ на частицу в зависимости от характера взаимодействия. Мерой
. Ее значение колеблется в интервале 0,1÷ 7,0 эВ на частицу в зависимости от характера взаимодействия. Мерой  является работа, которую необходимо совершить для удаления частицы из кристалла.
является работа, которую необходимо совершить для удаления частицы из кристалла.
При химическом взаимодействии, приводящем к образованию кристалла, различают несколько основных типов связи, представленных на схеме 13.1.1. Более подробное изложение вопроса о типах связи можно найти в [11,14].
Кроме основных типов связей между частицами в твердом теле возможны смешанные связи. Различные сочетания взаимодействий приводят к многообразию строения кристаллов. Такое явление как анизотропия кристаллов становится очевидным благодаря рассмотренной модели материального тела. Действительно, ведь в различных плоскостях, которые можно провести в кристалле, расстояния между частицами оказываются различными. Так как силы, действующие между частицами, зависят от расстояния, то физические свойства кристаллов (оптические, электрические, механические) зависят от направления, а в этом и заключается их анизотропия. Следует также отметить, что между 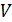 , температурой плавления кристаллов (при постоянном давлении) и энергией связи наблюдается прямая корреляция.
, температурой плавления кристаллов (при постоянном давлении) и энергией связи наблюдается прямая корреляция.
Схема 13.1.1.
| Классификация кристаллов по типу связи |
Энергия связи 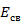 ,
Дж/моль ,
Дж/моль
|
Кристаллы с ковалентной связью
 : : 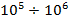 Примеры: кремний Si, алмаз C, сульфат цинка ZnS.
Примеры: кремний Si, алмаз C, сульфат цинка ZnS.
|
Ионные кристаллы
 : : 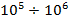 Примеры: хлорид натрия NaCl, флюорид CaF2.
Примеры: хлорид натрия NaCl, флюорид CaF2.
|
Металлические кристаллы
 : : 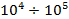 Примеры: медь Cu, алюминий Al, железо Fe.
Примеры: медь Cu, алюминий Al, железо Fe.
|
Кристаллы с водородной связью
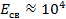 Примеры: фтороводород HF, фторид аммония NH4F.
Примеры: фтороводород HF, фторид аммония NH4F.
|
Молекулярные кристаллы
 : :  Примеры: неон Ne,
аргон Ar,
криптон Kr,
ксенон Xe.
Примеры: неон Ne,
аргон Ar,
криптон Kr,
ксенон Xe.
|
13.2. Реальные газы и жидкости
При описании свойств газов мы считали их идеальными только потому, что выполнялись одновременно два условия:
• Среднее расстояние между молекулами 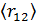 в десятки тысяч раз больше чем их собственный размер
в десятки тысяч раз больше чем их собственный размер 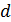 :
: 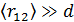 .
.
• Потенциальная энергия взаимодействия частиц пренебрежимо мала по сравнению с их кинетической энергией.
Если эти условия не выполняются, например, при высоких давлениях и низких температурах, то отклонение от идеальности может быть установлено экспериментально, путем проверки справедливости уравнения Клапейрона-Менделеева для некоторого газа при различных давлениях. Измерения позволяют установить область, где отклонения от этого закона становятся значительными.
Чувствительным индикатором неидеальности газов является термодинамический коэффициент сжатия. Для идеального газа согласно его определению.

Экспериментальные измерения этого свойства показывают, что при высоких давлениях
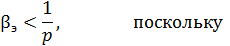
существенны силы отталкивания, а при низких давлениях

- существенны силы притяжения.
У жидкостей сжимаемость в тысячи раз меньше, чем у газов, поскольку молекулы упакованы очень плотно. Требуются достаточно большое давление, чтобы совсем незначительно уменьшить объем жидкости. Числовое значение  для большинства жидкостей порядка 10-10 ÷ 10-12
для большинства жидкостей порядка 10-10 ÷ 10-12  .
.
Потенциал межмолекулярного взаимодействия
Для описания взаимодействий молекул в жидкостях и газах широко используется потенциал Леннарда-Джонса

где  и
и  – константы, индивидуальные для каждого вещества. Первое слагаемое в (13.6) соответствует энергии короткодействующего отталкивания, а второе слагаемое дает энергию дальнодействующего притяжения между двумя молекулами в зависимости от расстояния
– константы, индивидуальные для каждого вещества. Первое слагаемое в (13.6) соответствует энергии короткодействующего отталкивания, а второе слагаемое дает энергию дальнодействующего притяжения между двумя молекулами в зависимости от расстояния 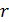 между ними.
между ними.
Характер изменения  показан на рис. 13.2.
показан на рис. 13.2.
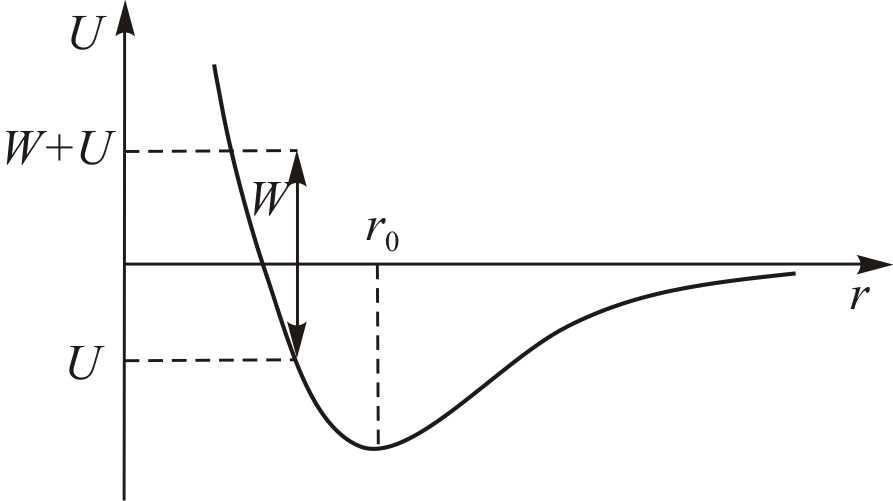
Рис. 13.2.
Природа межмолекулярного взаимодействия
Теперь в общих чертах обсудим природу притяжения и отталкивания молекул в жидкостях и газах. Силы притяжения, действующие на больших расстояниях между молекулами, называются силами Ван-дер-Ваальса. Эти силы возникают благодаря наличию у молекулы постоянных или индуцированных электрических дипольных моментов. Полярные молекулы, обращенные друг к другу разноименными зарядами, притягиваются друг к другу. При таком взаимодействии отсутствует какой либо обмен зарядами в отличие от ковалентной и ионной связи. Кстати, в молекулярных кристаллах также действуют только силы Ван-дер-Ваальса.
Короткодействующие силы отталкивания в веществе возникают вследствие перекрывания электронных оболочек молекул. Одноименные заряды отталкиваются. Чтобы рассчитать энергию их взаимодействия необходимо знать распределение электронной плотности в пространстве. Такую информацию можно получить только в рамках квантово-механического подхода. Мы не имеем возможности углубляться в понимание этого вопроса. Однако, следует обратить внимание на то, что механизм соударения молекул реальных газов не включает в себя прямого упругого удара как это предполагается в модели идеального газа.
Структура жидкостей
Молекулы в жидкостях находятся значительно ближе друг к другу, чем в газах. Силы Ван-дер-Ваальса действуют в них во всем интервале давлений и температур области существования жидкого состояния. В расположении частиц жидкости наблюдается ближний порядок. Это означает, что по отношению к любой частице расположение ближайших частиц является упорядоченным. На фоне хаотического перемещения молекул относительно друг друга в жидкостях могут образовываться и существовать в течение продолжительных промежутков времени агрегаты молекул. Эти структурные образования по своим свойствам близки твердому телу. Сочетание у жидкостей свойств газа и твердого тела делает их теоретическое описание весьма затруднительным. В жидкостях с удлиненными молекулами (особенно в органических) наблюдается одинаковая ориентация их в пределах значительного объема, что приводит к появлению анизотропии ряда свойств. Возникает некоторое промежуточное состояние между жидкостью и твёрдым телом, которое называется жидким кристаллом.
Жидкие кристаллы обладают очень важными оптическими свойствами, что обеспечило их многочисленные применения и большой интерес к их изучению. На свойства жидких кристаллов сильное влияние оказывают электрические и магнитные поля, что открывает возможности управления световыми потоками с помощью этих кристаллов. Широко известны цифровые указатели на жидких кристаллах, а также дисплеи. Большим преимуществом жидкокристаллических пленок являются их относительная дешевизна и малые величины используемых электрических мощностей и напряжений.
Несмотря на отсутствие теории жидкостей, некоторые их свойства изучены достаточно полно, например, поверхностное натяжение и связанные с ним явления. Предлагаемый курс лекций не содержит данную тему, хотя она заявлена в программе дисциплины. Её самостоятельное изучение вами предусматривается в физическом практикуме по молекулярной физике, содержащем две лабораторные работы по данной теме. В описании этих работ достаточно подробно излагается теория поверхностных явлений, там же даны ссылки на учебную литературу.
Теперь мы обратимся к изучению процесса перехода из газообразного состояния в жидкое, что, безусловно, может расширить наши представления об этих состояниях вещества.
Дата добавления: 2015-08-11; просмотров: 1186;
