Классификация дисперсных систем. Рассматривается классификация именно дисперсных систем, т.к
Рассматривается классификация именно дисперсных систем, т.к. коллоидные растворы являются видом дисперсных систем.
Следует отметить, что коллоидная система - это лишь одно из состояний нахождения вещества в другом веществе, это не постоянное свойство вещества. Например, сахар или каменная соль (NaCl) при растворении в воде образуют истинные растворы, а в керосине или в бензоле образуют коллоидные растворы (т.к. в этих растворителях практически нерастворимы).
Существует несколько классификаций по различным признакам.
I. по топографическому строению
Представим себе кубик какого-либо вещества, который будем разрезать параллельно одной из его плоскостей, затем полученные пластинки нарежем на палочки, а последние на кубики. В результате такого диспергирования (дробления) получаются следующие системы:
 |
II. по степени дисперсности
Таблица. Классификация корпускулярно дисперсных систем по степени дисперсности.
| системы | раздробленность вещества | поперечник частиц, см | степень дисперсности D, см-1 | число атомов в одной частице |
| грубодисперсные (микрогетерогенные) | макроскопическая | 1 – 10-2 | 1 – 102 | > 1018 |
| микроскопическая | 10-2 – 10-5 | 102 – 105 | > 109 | |
| предельно высоко дисперсные (ультра микрогетерогенные) | коллоидная | 10-5 – 10-7 | 105 – 107 | 109 - 103 |
| молекулярные и ионные (истинные растворы) | молекулярная и ионная | 10-7 – 10-8 | > 107 | < 103 |
III. по однородности размеров частиц

| 
|
 монодисперсные – все частицы дисперсной фазы имеют одинаковые размеры монодисперсные – все частицы дисперсной фазы имеют одинаковые размеры
|  полидисперсные – частицы дисперсной фазы неодинакового размера полидисперсные – частицы дисперсной фазы неодинакового размера
|
IV. по агрегатному состоянию
Таблица. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды.
| дисперсная фаза | дисперсионная среда | тип системы | примеры |
| т | т | твердые коллоидные растворы | минералы, цветные стекла, рубин |
| ж | т | гели коллоиднодисперные | почва, жемчуг |
| г | т | пористые системы | пемза, кирпич, активированный уголь |
| т | ж | грубодисперсные – суспензия (взвесь) | взмученная глина в воде |
| коллоиднодисперсные - лиозоли | золи металлов | ||
| ж | ж | грубодисперсные - эмульсии | капли масла в воде |
| коллоиднодисперсные - лиозоли | молоко, майонез | ||
| г | ж | грубодисперсные – пены, газовые эмульсии | пены мыльные, противопожарные |
| т | г | грубодисперсные - пыль | дым, смог |
| коллоиднодисерсные - аэрозоль | аэрозоли | ||
| ж | г | грубодисперсные | туман, облака |
| коллоиднодисперсные - аэрозоль |
т – твердое состояние, ж – жидкое состояние, г - газообразное состояние.
V. по термодинамической устойчивости
Изучение процессов и характера взаимодействия дисперсионной среды и дисперсной фазы привело к тому, что коллоидные системы не могут рассматриваться как единое целое, так, имеются две группы, отличные по взаимодействиям между частицами дисперсной фазы (д.ф.) и дисперсионной среды (д.с.):

| 
|
| лиофобные или коллоидные растворы | лиофильные или растворы ВМС (высокомолекулярных соединений) |
| - частицы д.ф. не взаимодействуют или слабо взаимодействуют с частицами д.с.; | - частицы д.ф. сильно взаимодействуют с частицами д.с.; |
| - их получают с затратой энергии; | - образованы самопроизвольно; |
| - структурные частицы – мицелла – сложный многокомпонентный агрегат с переменным числом адсорбированных ионов или молекул. | - представляют собой истинные растворы. |
VI. по наличию или отсутствию взаимодействии между частицами дисперсной фазы:

| 
|
| свободнодисперсные | связнодисперсные |
| - частицы д.ф. не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести; | - возникают при контакте частиц д.ф., приводящем к образованию структуры в виде каркаса или сетки; такое структурирование называется - гель |
| - они текучи; | - твердообразны; |
| примеры: аэрозоли, лиозоли, разбавленные суспензии и эмульсии. | примеры: порошки, концентрированные эмульсии и суспензии (пасты), пены. |
Отдельно выделяют капиллярнодисперсные системы – это системы, в которых частицы дисперсной фазы образуют сплошную массу, частицы дисперсионной среды ее пронизывают как поры ил капилляры. Примером капиллярнодисперных систем могут быть древесина, мембраны, диафрагмы, кожа, бумага, картон, ткани.
Среди всего множества дисперсных систем особый интерес представляют коллоидные растворы или золи (от латинского «solutio» - раствор), которые рассматриваются в курсне изучения дисциплины «коллоидная химия».
Коллоидные растворы – это высокодисперсные системы с жидкой дисперсной средой.
Коллоидные частицы называются мецеллами.
Строение мицеллы рассмотрим на примере образования коллоидного раствора иодида серебра AgI: при взаимодействии очень разбавленных растворов AgNO3 и KI:
AgNO3 + KI = AgI↓ + KNO3
Ag+ + NO3 - + K+ + I- = AgI↓ + K+ + NO3-
нерастворимые молекулы AgI образуют ядро
1) вещество ядра имеет кристаллическую или аморфную структуру и состоит из нескольких тысяч нейтральных молекул или атомов:
m[AgI]
ядро коллоидной частицы
2) Ядро адсорбирует на своей поверхности те или иные ионы, имеющиеся в растворе. Обычно адсорбируются те ионы, которые входят в состав ядра, т.е. или Ag+ или I-. Если раствор получали при избытке KI, то адсорбируются I-. Они достраивают кристаллическую решетку ядра, прочно образуют адсорбционный слой и придают ядру отрицательный заряд:
m[AgI]nI-
Ионы, адсорбирующиеся на поверхности ядра и придающие ему соответствующий заряд называются потенциалопределяющими ионами.
3) В растворе находятся ионы, противоположные по знаку – это противоионы - K+, они электростатически притягиваются ионами адсорбционного слоя. Но только часть ионов K+ притягиваются потенциалопределяющими ионами. Таким образом формируется гранула – ядро с адсорбционным слоем.
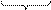
 {m[AgI]nI-(n-x) K+}x-
{m[AgI]nI-(n-x) K+}x-
 ядро адсорбционный слой
ядро адсорбционный слой
гранула
4) Оставшаяся часть противоионов образует диффузионный слой ионов.
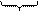
 {m[AgI]nI-(n-x) K+}x-xK+
{m[AgI]nI-(n-x) K+}x-xK+
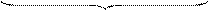 гранула диффузионный слой
гранула диффузионный слой
мицелла
Ядро с адсорбционным и диффузионным слоями представляют собой мицеллу.
Наличие одноименного заряда у всех гранул является важным фактором устойчивости.
Заряд препятствует слипанию и укрупнению коллоидных частиц.
При добавлении к золям электролитов происходит уменьшение зарядов гранул, что приводит к слипанию частиц.
Соединение коллоидных частиц в более крупные агрегаты называется коагуляция.
В результате коагуляции частицы могут или выпасть в осадок под влиянием силы тяжести – это процесс седиментации, или образовать полутвердую упругую массу – гель или студень.
Пример сложной коллоидной системы: молоко.
Составные части: вода, жир, казеин и молочный сахар:
жир в виде эмульсии: при стоянии поднимается кверху → сливки;
казеин в виде коллоидного раствора: самопроизвольно не выделяется, но при подкислении уксусом осаждается → творог или в естественных условиях казеин выделяется при скисании молока;
молочный сахар в виде молекулярного раствора: выделяется лишь при испарении воды.
Еще примеры коллоидных систем: протоплазма живых клеток, кровь, сок растений – это золи.
Дата добавления: 2015-08-11; просмотров: 1216;
