Краткая история коллоидной химии
Первые практические сведения о коллоидах содержатся в трудах Аристотеля и алхимиков.
Затем у Берцелиуса (1824 – 1834 г.г.) обратил внимание на особые свойства суспензий нерастворимых осадков: их неустойчивость и опалесценцию.
Сельми Франческо 1845 г. (Италия) исследовал свойства истинных растворов и псевдорастворов. Он обратил внимание на аномальны свойства некоторых растворов – гидрозолей неорганических веществ (серы, сульфида, мышьяка):
1) сильно рассеивают свет;
2) растворенные в них вещества выпадают в осадок при добавлении солей, не взаимодействующих с растворенным веществом.
Ф. Сельми рассматривал псевдорастворы как «распределение вещества в жидкой среде, не сопровождающееся разбавлением до молекул».
В 1857 г. Макс Фарадей исследовал системы, содержащие золото, распределенное в воде (питьевое золото).
1751 г. в трудах М.В. Ломоносова описываются различия между явлениями кристаллизации и свертывания, также описывается получение золей золота в воде и стекле (цветные стекла).
1809 г. Ф.Ф. Рейс (Россия) описывал явления электрофореза и электроосмоса.
1851 г. Давидов разработал теорию капиллярных явлений.
Впервые термин и понятие «коллоиды» были четко сформулированы Томасом Грэмом (Англия) в 1861 г., с появлением трудов которого обычно связывается возникновение коллоидной химии.
Т. Грэм разработал ряд методов приготовления и очистки коллоидов, используя различия в диффузии и диализе, и назвал коллоидами клееобразные вещества, от греч «колла» - клей (например, желатин, клей).
Большой вклад в развитие коллоидной химии внесли такие ученые как И.И. Борщев (Россия), П.П. Веймарн (Россия), П.Сухомлинский, Р. Зигмонди, И.И. Жуков, В. Оствальд, Б.В. Дерягин и т.д.
Основные понятия и определения
Истинные растворы являются гомогенными смесями веществ, в которых составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов.
Кроме гомогенных, существуют гетерогенные смеси, в которых визуально или с помощью оптических приборов можно различить области различных веществ, разграниченные поверхностью раздела. Такие области называются фазами.
Гетерогенная смесь состоит из двух или большего числа фаз.
Дисперсная система – гетерогенная смесь, в которой одна фаза в виде отдельных частиц распределена в другой.
В таких системах различают:

| 
|
| дисперсную фазу – раздробленное вещество (частицы) того или иного размера и формы. | дисперсионную среду – среда, в которой находится раздробленное (диспер-гированное) вещество. |
Важнейшей характеристикой дисперсных систем является степень дисперсности – средний размер частиц дисперсной фазы или степень раздробленности D – величина обратная размеру дисперсных частиц, измеряется [см-1].
D = 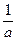
а – равно либо диаметру сферических или волокнистых частиц, либо длине ребра кубических частиц, либо толщине пленок.
а – называется поперечник частицы.
Степень дисперсности D численно равна числу частиц, которые можно уложить плотно в ряд (или в стопку пленок) на протяжении 1 сантиметра.
С повышением дисперсности все больше число атомов вещества находится в поверхностном слое – на границе раздела фаз, по сравнению с их числом внутри объема частиц дисперсной фазы.
Соотношение между поверхностью и объемом характеризует удельная поверхность:
Sуд = 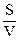
Sуд: а) для частиц сферической формы:
Sуд = 4πr2/4/3πr3 = 3/r = 6/d,
r – радиус шара,
d – диаметр шара.
б) для частиц кубической формы:
Sуд = 6l2/l3 = 6/l,
l – длина ребра куба.
Так, удельная поверхность вещества, раздробленного до микронных кубиков Sуд = 6·104 см-1.
При этом в объеме V = 1 см3 образуется 1012 микронных кубиков (1 микрон = 1 мк = 10-6 м, 1 м = 102 см, 1 мк = 10-4 см) с суммарной поверхностью S = Sуд ·V = 6·104 см-1 · 1 см3 = 6·104 см2 = 6·104 м2.
При дальнейшем дроблении 1 см3 вещества до кубиков коллоидной дисперсности, например, с длиной ребра l = 10-6 см их число в объеме V = 1 см3 равно 1018 частиц с суммарной поверхностью S = 6 · 106 см2 (600 м2) и Sуд = 6 · 106 см-1.
Таким образом, с повышением дисперсности вещества все большее значение имеют его свойства, определяемые поверхностными явлениями, т.е. совокупностью процессов, происходящих в межфазовой поверхности.
Своеобразие дисперсных систем определяется:
1) большой удельной поверхностью дисперсной фазы;
2) физико-химическим взаимодействием дисперсной фазы и дисперсной среды на границе раздела фаз.
Дата добавления: 2015-08-11; просмотров: 1744;
