Модели атома
 Открытый Дж. Томсоном электрон был первой частицей, входящей в состав атома и свидетельствующий о его сложном строении. Естественно, возник вопрос о строении атома. Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка
Открытый Дж. Томсоном электрон был первой частицей, входящей в состав атома и свидетельствующий о его сложном строении. Естественно, возник вопрос о строении атома. Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 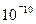 м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет
м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет
было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда, который на основании своих исследований по рассеянию 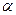 -частиц в веществе в 1911 году предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z — порядковый номер элемента в системе Менделеева, е - элементарный заряд), размер
-частиц в веществе в 1911 году предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z — порядковый номер элемента в системе Менделеева, е - элементарный заряд), размер 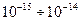 м и массу, практически равную массе атома, в области с линейными размерами порядка
м и массу, практически равную массе атома, в области с линейными размерами порядка 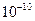 м. по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра должно вращаться Z электронов.
м. по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра должно вращаться Z электронов.
Несмотря на то, что модель атома Томсона была отвергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атомов.
Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 году датским физиком Нильсом Бором. Он поставил перед собой цель связать в единое целое эмпирические закономерности линейных спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата. Рассмотрим это на примере атома водорода.
Простейшим по своему строению атомом является атом водорода, состоящий из ядра вокруг которого движется электрон. Согласно первому постулату Бора, он движется по одной из круговых орбит, не излучая энергии. Причем момент количества движения электрона по этой орбите равен целому кратному некоторой величины 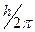 т.е. mvnrn =nh/2
т.е. mvnrn =nh/2 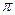 , где т — масса электрона; vn — его скорость на n-орбите; h = 6,62-10
, где т — масса электрона; vn — его скорость на n-орбите; h = 6,62-10  Дж·с - постоянная Планка;
Дж·с - постоянная Планка; 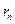 - радиус этой орбиты; п - главное квантовое число (п = /, 2, 3, ...). При переходе электрона с одной орбиты на другую атом водорода излучает или поглощает один квант энергии (второй постулат Бора: hv = Е
- радиус этой орбиты; п - главное квантовое число (п = /, 2, 3, ...). При переходе электрона с одной орбиты на другую атом водорода излучает или поглощает один квант энергии (второй постулат Бора: hv = Е 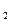 -E
-E 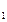 , где v - частота излучения). Энергия электрона в атоме на соответствующей орбите может быть вычислена по формуле:
, где v - частота излучения). Энергия электрона в атоме на соответствующей орбите может быть вычислена по формуле:

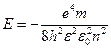 , (4.7)
, (4.7)
где е — заряд электрона; m - масса электрона; 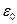 - диэлектрическая проницаемость вакуума; п - 1,2, 3,... — номер орбиты.
- диэлектрическая проницаемость вакуума; п - 1,2, 3,... — номер орбиты.
Длина волны 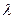 излучения испускаемого атомом водорода при переходе с одной орбиты на другую может быть определена из формулы:
излучения испускаемого атомом водорода при переходе с одной орбиты на другую может быть определена из формулы:
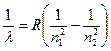 , (4.8)
, (4.8)
где R = 1,097·107 1/м и называется постоянной Ридберга; п1 и п2 - номера орбит. Формула (4.8) называется сериальной формулой.
В спектре атома водорода обнаружено пять серий спектральных линий. Серия Лаймана соответствует изучению в ультрафиолетовой части спектра электромагнитных волн, серия Бальмера - видимой и серии Пашена, Брикетта и Пфундта — инфракрасной.
Наряду с определенными успехами в теории Бора обнаружились и существенные недостатки: невозможность применить к многоэлектронным атомам, рассчитать интенсивность линий излучения и другие, но она явилась переходным этапом к созданию квантовой механики. Изучение строения атома позволило открыть необычайные свойства микрочастиц (главное из которых — корпускулярно-волновой дуализм) и создать теорию движения микрочастиц - квантовую механику. А на основе ее законов удалось довольно точно рассчитать строение электронной оболочки различных атомов, детальнейшим образом разобраться в их спектрах, объяснить Периодическую систему элементов Д. И. Менделеева, выяснить природу химической связи. Успехи в этом направлении заложили фундамент физики твердого тела, открыли перспективы целенаправленного поиска новых материалов с необходимыми свойствами, пути создания новых производств, без которых немыслима современная техника.
Дата добавления: 2015-08-11; просмотров: 746;
