Всего углерода в газы
Уравнение реакции в общем виде:
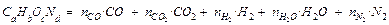
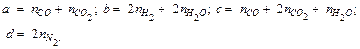
Между продуктами разложения идет обратимая реакция (реакция водяного газа):
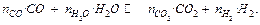
Выражая концентрации компонентов водяного газа через искомые величины 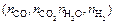 согласно учению о химическом равновесии:
согласно учению о химическом равновесии:
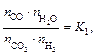
где 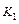 – константа равновесия реакции водяного газа.
– константа равновесия реакции водяного газа.
Константы равновесия могут быть выражены через равновесные концентрации реагирующих веществ ( 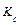 ) или через равновесные парциальные давления (
) или через равновесные парциальные давления ( 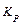 ). Если считать продукты превращения идеальным газом, то для реакции
). Если считать продукты превращения идеальным газом, то для реакции 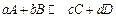 можно вывести:
можно вывести:
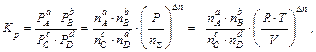
где 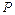 – общее давление аппаратов взрыва;
– общее давление аппаратов взрыва;
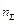 ,
, 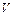 ,
, 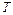 – соответственно общее число молей, объём и температура этих продуктов, а
– соответственно общее число молей, объём и температура этих продуктов, а 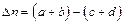 .
.
Таким образом для того чтобы определить 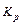 по таблице надо знать T, а чтобы вычислить Т надо знать состав продуктов взрыва. Задаются Т и определяют
по таблице надо знать T, а чтобы вычислить Т надо знать состав продуктов взрыва. Задаются Т и определяют 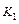 и решают уравнение. Определив
и решают уравнение. Определив 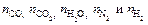 вычисляют Т.
вычисляют Т.
При расчёте мы принимали, что равновесие реакции водяного газа зависит только от температуры. При слишком высоких давлениях вместо парциального давления в 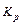 подставляются их фугативности.
подставляются их фугативности.
Отношение фугативности газа к его парциальному давлению называют коэффициентом активности. По определению
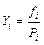 , (4.1)
, (4.1)
где 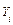 ,
, 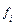 ,
, 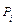 – соответственно коэффициенты активности, фугативности и парциальное давление
– соответственно коэффициенты активности, фугативности и парциальное давление 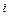 - го компонента газовой смеси.
- го компонента газовой смеси.
Из курса термодинамики известно:
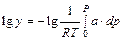 ,
,
где 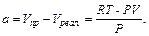
Можно показать, что:
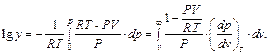
Заменяя в выражении константы равновесия водяного газа давления на фугативности, с учетом (4.1) имеем:
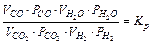 ,
,
или 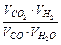 через G, получим:
через G, получим:
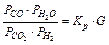 ,
,
G – обозначает поправочный множитель.
Дата добавления: 2015-08-08; просмотров: 1003;
