Особенности растворов электролитов.
Поскольку при диссоциации число частиц в растворе увеличивается, растворы электролитов обладают аномальными коллигативными свойствами.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент i Вант-Гоффа. Например,
π = icRT (3)
или
∆Тзам = iКкm (4).
Изотонический коэффициент i связан со степенью диссоциации 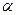
i = 1 + 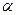 (
( 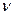 - 1) (5),
- 1) (5),
где 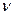 - количество ионов, образующихся при диссоциации одной молекулы. Коэффициент i для различных солей различен. С разбавлением раствора он растет, приближаясь к целым числам 2, 3, 4. Для солей аналогичного состава эти числа одинаковы. Например, для всех солей, образованных одновалентными металлами и одноосновными кислотами при достаточном разбавлении их растворов изотонический коэффициент приближается к 2, для солей образованных двухвалентными металлами и одноосновными кислотами к 3.
- количество ионов, образующихся при диссоциации одной молекулы. Коэффициент i для различных солей различен. С разбавлением раствора он растет, приближаясь к целым числам 2, 3, 4. Для солей аналогичного состава эти числа одинаковы. Например, для всех солей, образованных одновалентными металлами и одноосновными кислотами при достаточном разбавлении их растворов изотонический коэффициент приближается к 2, для солей образованных двухвалентными металлами и одноосновными кислотами к 3.
Слабые электролиты. Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации уксусной кислоты можно записать
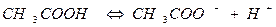 (6).
(6).
Поэтому константа равновесия КС будет равна:
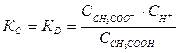 (7). Константу равновесия для процесса диссоциации называют константой диссоциации КD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается.
(7). Константу равновесия для процесса диссоциации называют константой диссоциации КD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается.
В соответствии с принципом Ле-Шателье температурная зависимость КD указывает на то, что процесс диссоциации является экзотермическим, то есть энергия гидратации ионов выше энергии внутримолекулярных связей.
Константа диссоциации указывает на прочность молекул слабых электролитов в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Активность и коэффициент активности.
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона аi выражается в виде произведения концентрации иона сi на его коэффициент активности 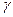 i :
i :
аi = 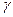 i сi (8).
i сi (8).
Экспериментально определить активности катиона а+ и аниона а- невозможно, так как они не существуют по разделности. Поэтому вводится понятие средней ионной активности а 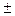 . Для электролита, образующего n+ катионов и n- анионов
. Для электролита, образующего n+ катионов и n- анионов
a± = (a+n+ ∙a-n-)1/n (9),
где n = n+ + n-.
Аналогично определяется средний ионный коэффициент активности γ±
γ± = (γ+n+ ∙γ-n-)1/n (10).

Дата добавления: 2015-08-08; просмотров: 1361;
