Произведение растворимости.
Большинство веществ малорастворимо в воде, поэтому очень часто имеют дело с системами, в которых в состоянии равновесия находится осадок и насыщенный раствор электролита. Это равновесие носит динамический характер, вследствие чего скорость процесса растворения должна совпадать со скоростью его кристаллизации. При растворении электролита в воде, например, соли, в раствор переходят не молекулы, а ионы. Поэтому равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами.
Равновесие в насыщенном растворе электролита АmBn можно представить так:
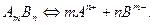
Прямой процесс - это растворение осадка, а обратный процесс – это кристаллизация осадка из насыщенного раствора.
Выражение константы равновесия для этого процесса имеет вид
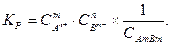
Концентрация твердой соли 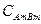 является постоянной величиной и поэтому её можно ввести в константу равновесия Кр. Таким образом, получаем
является постоянной величиной и поэтому её можно ввести в константу равновесия Кр. Таким образом, получаем
Кр = 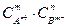 .
.
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Данная величина количественно характеризует способность электролита растворяться. Данную величину называют произведением растворимости
ПР = 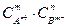 (13).
(13).
Следует иметь в виду, что произведение растворимости, вычисленное без учета коэффициента активности, является постоянной величиной только для малорастворимых электролитов и при условии, что концентрации других ионов, находящихся в растворе, малы.
Произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активности ионов малорастворимого электролита в растворе.
Произведение растворимости для большинства электролитов рассчитано и содержится в таблицах. Зная произведение растворимости, можно вычислить, выпадает ли в данных условиях вещество в осадок. Условием образования осадка малорастворимого электролита является превышение произведения активностей ионов этого электролита в растворе над табличной величиной произведения растворимости.
Если активность или концентрация одного из ионов малорастворимого электролита увеличится, то равновесие сместится, и, соответственно, активность или концентрация другого иона уменьшится.
Дата добавления: 2015-08-08; просмотров: 1062;
