Теория электролитической диссоциации Аррениуса.
Для объяснения особенностей водных растворов электролитов шведским химиком С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. Основные положения теории следующие:
1. Электролиты при растворении в воде распадаются на ионы – положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Среди таких ионов встречаются простые, например, Na+, Mg2+, Al3+ и сложные, состоящие из нескольких атомов, например, NO3-, SO42-, PO43-. В растворе ионы беспорядочно передвигаются в различных направлениях.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Первые называются катионами, а вторые анионами.
3. Диссоциация – обратимый процесс. Одновременно с распадом молекул на ионы протекает обратный процесс – соединения ионов в молекулу.
Поэтому в уравнениях электролитической диссоциации стоит не знак равенства, а знак обратимости ↔. Например, уравнение диссоциации молекулы электролита КА на катион К+ и анион А- записывается в виде
КА 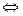 К+ + А- (1).
К+ + А- (1).
Теория электролитической диссоциации полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации электролитов
Под степенью диссоциации электролита понимается отношение числа диссоциированных на ионы молекул n к общему числу молекул растворенного электролита N, то есть
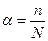 (2).
(2).
В зависимости от степени диссоциации различают слабые и сильные электролиты. Сильные электролиты при больших концентрациях диссоциированы более чем на 1/2. Степень диссоциации слабых электролитов очень мала по сравнению с 1. Сильные электролиты – это большинство нейтральных солей, сильные кислоты (НСl, HClO4, H2SO4), сильные основания (NaOH, KOH). Слабые электролиты – это большинство органических кислот, неорганические слабые кислоты и слабые основания, некоторые нейтральные соли CdCl2, Fe(CH3COO)3. Особенно слабыми электролитами являются вода, сероводород, синильная и борная кислоты.
Между сильными и слабыми электролитами существует переходная группа, которую образуют соли тяжелых металлов, а также некоторые сильные органические кислоты: лимонная, щавелевая, муравьиная.
Степень диссоциации зависит от природы электролита и растворителя, а также от концентрации электролита. С уменьшением концентрации степень диссоциации увеличивается, а при сильном разведении раствора, а→1, и различия между сильно и слабодиссоциирующими электролитами сглаживаются.
Степень диссоциации зависит и от диэлектрической проницаемости растворителя ε. Чем больше диэлектрическая проницаемость, тем сильнее диссоциирует электролит. В воде электролитическая диссоциация может быть сильной, а в ацетоне и в особенности бензоле – слабой. Диэлектрическая проницаемость ε воды, ацетона и бензола соответственно равна 80, 21 и 2,3. Эта закономерность, установленная Нернстом и Томсоном в 1893 г., объясняется тем, что, согласно закону Кулона, сила притяжения между разноименно заряженными ионами обратно пропорциональна диэлектрической проницаемости ε.
Дата добавления: 2015-08-08; просмотров: 1534;
