Скорость химической реакции
Термин скорость реакции означает скорость, с которой расходуются реагенты при протекании химической реакции. Скорости реакций могут сильно отличаться. В некоторых реакциях превращение исходных реагентов в продукты реакции происходит мгновенно, например, взрывы, ионные реакции.
Так как химические процессы могут протекать в системах, состоящих из одной или нескольких фаз, то различают гомогенные и гетерогенные реакции. Гомогенные химические реакции протекают в одной фазе, например, в смеси газов, в жидком растворе, в твердом теле. В таких системах реакции протекают во всем объеме. Системы, состоящие из нескольких фаз, являются гетерогенными. В них реакция протекает на поверхности раздела фаз. Скорости гомогенных и гетерогенных реакций определяются различно.
При протекании химической реакции с течением времени изменяются количества реагирующих веществ. Однако изменение количества вещества в реакционном пространстве может быть обусловлено как протеканием реакции, так и обменом веществом с окружающей средой. Поэтому отдельно рассматривают кинетику химических реакций в закрытых и открытых системах.
Мы будем рассматривать закрытые системы. В закрытой системе изменение количества вещества с течением времени происходит только за счет протекания реакции.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени, в единице объёма (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций). Обычно скорость реакции характеризуют изменением количества вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции). В последнем случае если площадь поверхности твердого тела нельзя измерить, то скорость гетерогенной реакции относят к единице массы или объёма твердой фазы, а не к единице площади поверхности.
Таким образом, скорость химической реакции в газовой фазе или в растворе определяется изменением числа молекул (или числа молей n) вещества в единицу времени в единице объёма:
v = ± 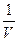
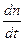 (1).
(1).
Знак плюс используют, если скорость реакции определяют по продукту, а минус – по исходному реагенту. Если реакция протекает при постоянном объёме, то скорость выражают через молярную концентрацию
с = 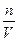 (2),
(2),
которая имеет размерность моль∙л-1
v = ± 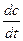 (3).
(3).
Молярную концентрацию часто обозначают квадратными скобками, например, концентрация вещества А запишется как [А]. Для реакции
аА + bB + …→dD + eE + …
скорость определяют образом
v = - 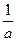
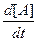 = -
= - 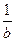
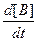 =
= 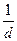
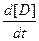 =
= 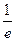
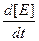 (4),
(4),
где а, b, с, d – стехиометрические коэффициенты; A, B, C, D – символы веществ.
Если в моменты времени t1 и t2 концентрация одного из исходных веществ равны соответственно с1 и с2, то среднюю скорость vср в интервале времени t1 и t2 можно найти по формуле
vср = (с1 – с2)/(t1 – t2) = -  (5).
(5).
Поскольку речь идет об убыли концентрации исходного вещества, изменение концентрации берется со знаком минус. На рисунке приведен график зависимости концентрации исходного вещества от времени.
Для реакций, протекающих в газовой фазе, скорость реакции можно определить через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль∙л-1 ∙сек-1; моль ∙см-3 ∙сек-1; Па ∙сек-1 .
О скорости реакции можно судить также по скорости изменения какого-либо свойства системы, например, окраски, интенсивности поглощения света, угла оптического вращения, электропроводности.
Экспериментальное определение скорости реакции
Рассмотрим экспериментальное определение скорости реакции на примере реакции, описываемой уравнением:

Дело осложняется тем, что в ходе реакции ее скорость меняется. Обычно скорость реакции максимальна вначале и постепенно уменьшается, приближаясь к нулевой.
После добавления разбавленной хлороводородной кислоты НСl к карбонату кальция, реакционная смесь сразу же бурно вскипает из-за быстрого образования диоксида углерода. По мере замедления реакции выделение пузырьков уменьшается. Выделяющийся диоксид углерода собирают с помощью газовой пипетки (газового шприца) и определяют его объём. За изменением скорости реакции можно проследить, измеряя объем выделившегося СО2 через равные промежутки времени по мере протекания реакции. Результаты эксперимента приведены в таблице 1.
Таблица 1
Объём, выделившегося диоксида углерода в результате реакции
взаимодействия хлороводородной кислоты с карбонатом кальция
| Время, с | Объем, собранного СО2 , см3 |
Если по этим данным построить график, то получится кривая скорости реакции.
Кривая скорости реакции показывает изменение со временем количества образующегося продукта либо используемого реагента.
Кривая скорости реакции показывает изменение со временем количества образующегося продукта.
Угол наклона касательной к кривой скорости реакции в какой-либо её точке, показывает, насколько быстро протекает реакция в соответствующий момент времени. Чем круче угол наклона касательной к кривой скорости, тем быстрее протекает реакция.
На рис. 1 представлены угол наклона касательной к кривой скорости, соответствующий начальной скорости реакции (касательная 1) и в момент t=35 сек (касательная 2). По наклону касательной к кривой скорости реакции видно, что реакция протекает быстрее в первый момент. По мере протекания реакции наклон касательной к кривой уменьшается, то есть скорость реакции замедляется.
Для измерения скорости реакции используют различные методы: физические, химические, электрохимические.
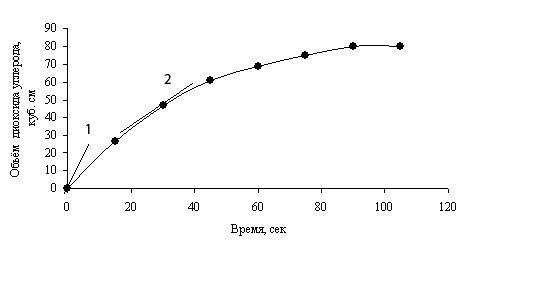
Рис. 1. Кривая скорости реакции между разбавленной HCl и CaCO3
Физические методы измерения скорости реакции обычно применяют для нахождения изменения давления или объёма в ходе реакции. Если число молей газообразных исходных реагентов не отличается от числа молей газообразных продуктов, то в этом случае нельзя определить скорость реакции, измеряя давление или объём.
Например, для реакции
2NO (г) + O2 (г) → 2NO2 (г)
можно определить скорость реакции, измеряя давление или объём. Однако в реакции
H2 (г) + I2 (г) → 2HI (г)
не происходит изменения объёма. Поэтому скорость этой реакции нельзя определить, измерением давления или объёма.
Химические методы анализа также используют для измерения скорости реакции. Отбирая небольшие пробы реакционной смеси в разные моменты времени и анализируя их тем или иным химическим методом, определяют скорость реакцию Например, реакция омыления этилацетата
C2H5CO2C2H5 (водн.) + NaOH (водн.) → C2H5CO2Na (водн.) + С2Н5ОН (водн.)
Через равные промежутки времени по мре протекания реакции из реакционной смеси берут пробу и титруют её кислотой. Это дает возможность определить концентрации гидроксида натрия в реакционной смеси в ходе реакции, и соответственно его убыль и скорость реакции.
Электрохимические методы также позволяют измерить скорости многих реакций. Используя измерение электропроводности, можно определить скорость реакции. Например, измерение электропроводности можно использовать для определения скорости омыления этилацетата. В данном случае электропроводность почти полностью обусловлена гидроксидом натрия, так как он является единственным сильным электролитом в реакционной смеси. По мере протекания реакции происходит потребление гидроксида натрия и следовательно уменьшение электропроводности раствора. По уменьшению электропроводности можно судить о скорости реакции. При этом нет необходимости брать образцы из реакционной смеси.
Дата добавления: 2015-08-08; просмотров: 1063;
