Донорно-акцепторный механизм
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Примерами образования химической связи по донорно-акцепторному механизму являются:
а) реакция аммиака с ионом водорода:
H+ + ׃NH3 = NH4+
Роль акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+ атом азота четырехвалентен.
б) такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl:
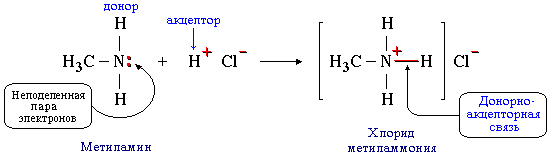
Атом азота отдает свою электронную пару на образование связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
в) реакция валентно насыщенных соединений аммиака и трифторида бора:
F3B + ׃NH3 = F3B׃NH3
акцептор донор1
В молекуле аммиака заселены все четыре орбитали азота, из них три – по обменному механизму электронами азота и водорода, а одна содержит электронную пару, оба электрона которой принадлежат азоту. Такая электронная пара называется неподеленной электронной парой. Образование соединения H3N · BF3 происходит за счет того, что неподеленная электронная пара аммиака занимает вакантную орбиталь фторида бора. При этом уменьшается потенциальная энергия системы и выделяется эквивалентное количество энергии.
В соединении H3N · BF3 азот и бор – четырехвалентны. Атом азота повышает свою валентность от 3 до 4 в результате использования неподеленной электронной пары для образования дополнительной химической связи. Атом бора повышает валентность за счет наличия у него свободной орбитали на валентном электронном уровне. Таким образом, валентность элементов определяется не только числом неспаренных электронов, но и наличием неподеленных электронных пар и свободных орбиталей на валентном электронном уровне.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями.
Сeмипoлярная связь является разновидностью донорно-акцепторной связи. Образование этой связи происходит при взаимодействии атома-донора пары электронов и атома-акцептора, не имеющих формальных зарядов. При этом на атоме-доноре возникает положительный заряд, а на атоме-акцепторе, предоставившем вакантную орбиталь, – отрицательный.
Например:

Атом кислорода в молекуле диметилового эфира (CH3)2O отдает свою неподеленную пару электронов для образования связи с атомом алюминия, имеющим во внешнем слое только 6 электронов и готовым его дополнить до 8 в соответствии с правилом октета). В результате на атоме кислорода появляется положительный заряд, а на атоме алюминия – отрицательный. Противоположные по знаку заряды на ковалентно-связанных атомах вызывают их дополнительное электростатическое притяжение (ионную связь).
Сочетание ковалентной и ионной связей называют сeмиполярной связью.
К семиполярным связям относится также связь азот-кислород в нитрогруппе NO2, входящей в состав азотной кислоты HO–NO2, ее солей и эфиров, а также нитросоединений R–NO2:
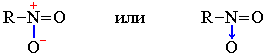
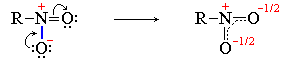
В приведенных формулах нитросоединения связи азота с кислородом неравноценны. Однако, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы. Следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому подвижной π-электронной пары двойной связи. В результате выравнивания электронной плотности в нитрогруппе формальный отрицательный заряд (-1) распределяется поровну (-1/2) между обоими атоми кислорода:
В плоском треугольном ионе (NO3)- делокализованные π-связи равномерно распределяются между всеми атомами кислорода. Точно также делокализованные π-связи равномерно распределяются между всеми атомами кислорода в соединениях (BO3)3- ,(CO3)2-,SO3 , в BF3 – между всеми атомами фтора,в анионах (PO4)3- и (SO4)2- , имеющих тетраэдрическое строение делокализованные связи равномерно распределяются между всеми атомами кислорода
( рис.2 )
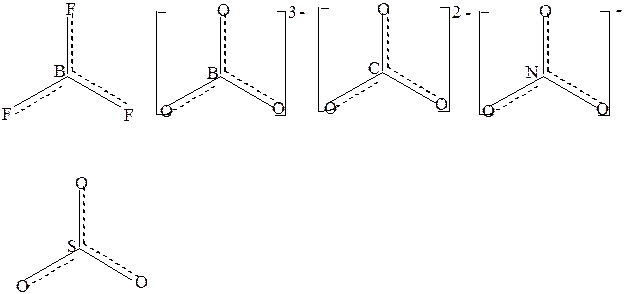

Рис.2Структурные формулы некоторых с соединений с учётом делокализации π-связи.
Дата добавления: 2015-08-08; просмотров: 5718;
