Механизмы образования химической связи
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи.
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону.
В молекулах Н2, Li2, Na2 связи образуются за счет неспаренных s-электронов атомов. В молекулах F2 и Cl2 – за счет неспаренных р-электронов. В молекулах HF и HCl связи образуются s-электронами водорода и
p-электронами галогенов. Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов.
Из квантовых ячеек N и Н можно видеть,
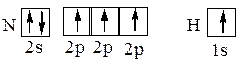
что атом азота имеет 3 неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4. Однако существуют молекулы, содержащие нечетное число электронов, например, NO, NO2, ClO2. Все они характеризуются повышенной реакционной способностью.
На отдельных стадиях химических реакций могут образовываться и валентно ненасыщенные группы, которые называются радикалами, например, H, NH2, O, CH3. Реакционная способность радикалов очень высока и поэтому время их существования, как правило, мало.
Дата добавления: 2015-08-08; просмотров: 876;
