Sp- гибридизация
sp–гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
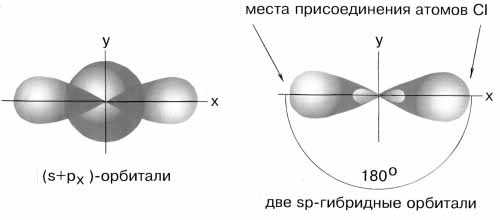
Рис.3 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
sp2-гибридизация
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу. Такова, например, конфигурация молекулы BF3 :
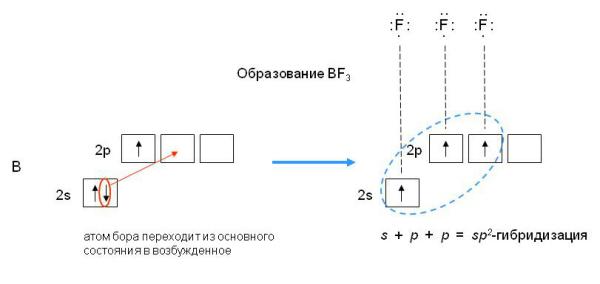
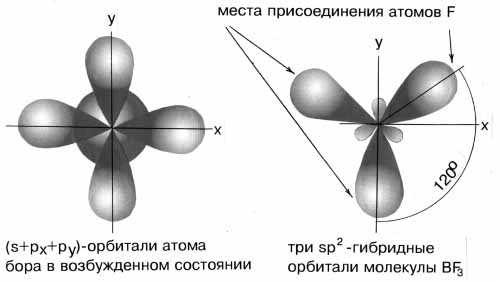
Рис.4sp2-гибридизация
sp3-гибридизация
sp3-гибридизация характерна для соединений углерода. В результате гибридизации одной s-орбитали и трех
р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4 и др.
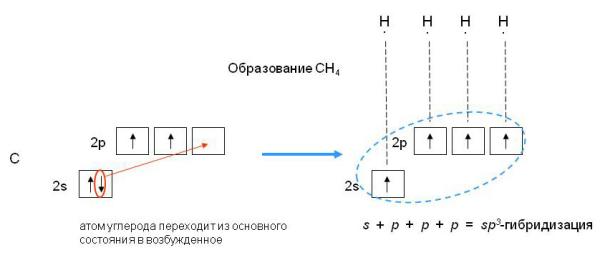
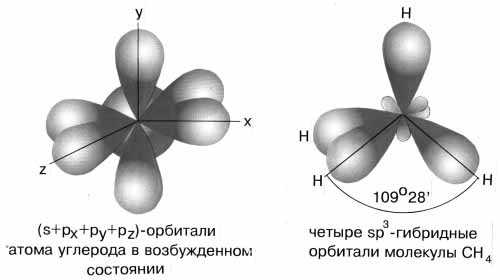
Рис.5 sp3-гибридизация
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 2). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105о, что довольно близко к теоретическому значению 109о.
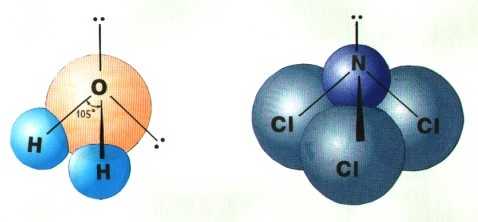
Рис.6 sp3-гибридизация атомов кислорода и азота в молекулах а) H2O и б) NCl3.
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому.
Теория гибридизации объясняет геометрию молекулы аммиака. В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.

Рис.7 sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Гибридизация объясняет также отличие угла между связями О-Н в угловой молекуле воды. В результате гибридизации 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp3, из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру.

Рис.8 sp3-гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как [SiF6]4-, [Fe(CN)6]4-. При этом молекула имеет конфигурацию октаэдра:
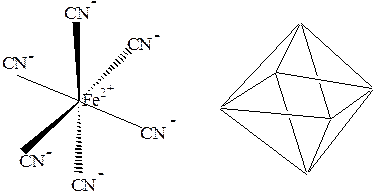
Рис. 9d2sp3-гибридизация в ионе [Fe(CN)6]4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом.
Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
Дата добавления: 2015-08-08; просмотров: 6872;
