Основные положения МВС
1)Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2)Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3)При образовании молекулы электронная структура составляющих её атомов в основном сохраняется, а все химические связи в молекуле могут быть представлены набором фиксированных(локализованных) двух центровых двухэлектронных связей. (не для всех соединений).
В целом электронная структура молекулы выглядит как набор различных валентных схем(метод локализованных пар).
Ковалентная связь образуется за счет перекрывания электронных облаков связываемых атомов. Существуют разные способы перекрывания этих электронных облаков.
1. Прямое перекрывание:
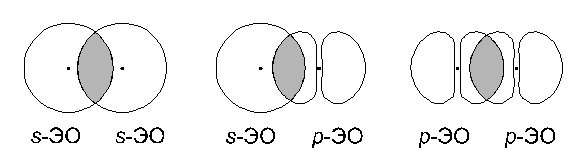
В этом случае единственная область перекрывания электронных облаков лежит на прямой, соединяющей ядра атомов. Связь, образованная таким образом, называется σ-связью.
В зависимости от вида перекрывающихся облаков может образоваться s-s,
s-p, p-p, s-d, p-d σ-связи.
σ-связь - ковалентная связь между атомами, образованная при прямом перекрывании их электронных облаков.
2. Боковое перекрывание:
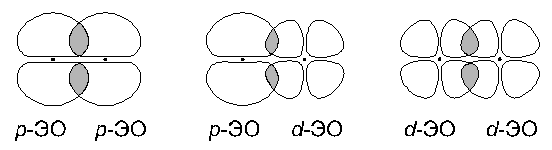
В этом случае две области перекрывания электронных облаков находятся по разные стороны от плоскости, в которой лежат ядра связываемых атомов. Связь, образованная при таком перекрывании ЭО, называется π- связью.
Как и в случае σ-связи, в зависимости от вида перекрывающихся облаков могут образоваться различные разновидности π-связи: p-p, p-d, d-d π-связи.
π-связь –ковалентная связь между атомами образованная при боковом перекрывании их электронных облаков.
При возникновении ковалентной связи происходит перекрывание электронных облаков атомов с образованием молекулярного электронного облака, сопровождающееся выигрышем энергии. Молекулярное электронное облако располагается между центрами обоих ядер и обладает повышенной электронной плотностью по сравнению с плотностью атомного электронного облака.
Дата добавления: 2015-08-08; просмотров: 892;
