Постулаты Бора
Выход из затруднительного положения, почему же электрон не падает на ядро, был предложен в 1913г. датским физиком Н. Бором. Он ввел идеи квантовой теории в ядерную модель Резерфорда и разработал теорию атома водорода, полностью подтвержденную экспериментально.
В основе боровской теории атома лежат 2 основных положения-постулата:
1. Электроны могут двигаться в атоме только по определенным орбитам, находясь на которых они, несмотря на наличие у них ускорения, не излучают:
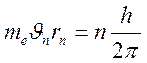 (8)
(8)
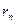 - радиус n-ой орбиты;
- радиус n-ой орбиты;
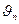 - скорость электрона на орбите;
- скорость электрона на орбите;
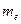 - масса электрона;
- масса электрона;
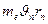 - момент импульса электрона на этой орбите;
- момент импульса электрона на этой орбите;
n – целое чисто ( 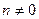 )
)
2. атом излучает или поглощает квант электромагнитной энергии при переходе электрона из одного стационарного состояния в другое:
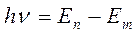 (9)
(9)
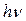 - энергия кванта равна разности энергий стационарных состояний электрона до (
- энергия кванта равна разности энергий стационарных состояний электрона до ( 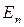 ) и после (
) и после ( 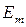 ) перехода.
) перехода.
Рассмотрим простейший атом - атом водорода. Он состоит из ядра, в состав которого входит один протон, и одного электрона, вращающегося вокруг ядра по круговой орбите.
На электрон со стороны ядра действует кулоновская сила притяжения, сообщая ему центростремительное ускорение. Поэтому:
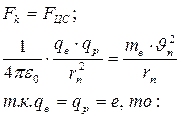
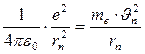 (10)
(10)
где е – заряд электрона и протона,
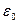 - электрическая постоянная (
- электрическая постоянная ( 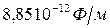 )
)
Поскольку должен выполняться 1-ый постулат Н. Бора, то по 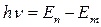 определим скорость
определим скорость 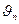 , возведем в квадрат и подставим в (10), получим:
, возведем в квадрат и подставим в (10), получим:
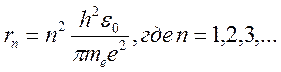 (11)
(11)
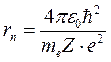
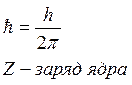
Из соотношения (11) следует, что радиусы орбит электрона в атоме водорода пропорциональны 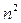 .
.
Подставив в (11) значения констант и считая n=1, получим значение первого боровского радиуса:
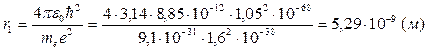
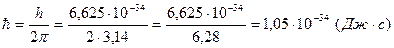
Скорость электрона:
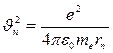 , откуда
, откуда
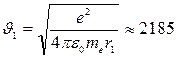 (км/с) - на 1-ом боровском радиусе.
(км/с) - на 1-ом боровском радиусе.
Дата добавления: 2015-08-08; просмотров: 1662;
