Спектры атома водорода по теории Бора
В атоме водорода вокруг ядра, несущего один электрический заряд е, движется один электрон. Ядро можно считать неподвижным, поскольку его масс в 1840 раз больше массы электрона; орбиты электрона можно в первом приближении полагать круговыми.
Определим полную энергию W электрона в атоме. Она слагается из кинетической энергии Wк поступательного движения электрона по орбите и потенциальной энергии Wп взаимодействия электрона с ядром.
Так как центростремительной силой, удерживающей электрон на орбите радиуса r, является кулоновская сила притяжения между электроном и ядром,
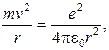 (8.1)
(8.1)
выражение кинетической энергии запишем в виде
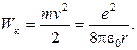 (8.2)
(8.2)
Что касается потенциальной энергии электрона, то она должна быть отрицательна и равна
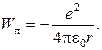 (8.3)
(8.3)
Поэтому 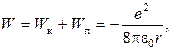 (8.4)
(8.4)
Т.е. полная энергия электрона в атоме оказывается отрицательной и равной по абсолютному значению ее кинетической энергии.
Решая совместно уравнение (8.1) и (7.4) (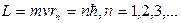 ), получим после простых преобразований выражение радиуса стационарных орбит атома водорода:
), получим после простых преобразований выражение радиуса стационарных орбит атома водорода:
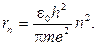 (8.5)
(8.5)
По формуле (8.5) можно рассчитать радиус любой стационарной орбиты атома водорода. Так, например, радиус ближайшей к ядру орбиты r1 ≈ 0,53 ∙ 10-10 м.
Подставляя в формулу (8.4) выражение радиуса (8.5), получим
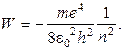 (8.6)
(8.6)
По этой формуле можно рассчитать энергию электрона для любого стационарного состояния. Так, например, для состояния с n= 1 W1≈ 21,68 ∙ 10- 19 Дж = - 13, 55 эВ.
|

В состоянии с n= 1 атом может находиться сколь угодно долго без воздействия извне. Это состояние называют основным состоянием.Все другие состояния атома (n > 1) - возбужденные. Для перевода атома из основного состояния в возбужденное состояние необходимо затратить энергию извне, т. е. возбудить атом.
Из формулы (8.6) следует, что энергетический спектр электрона в атоме водорода является дискретным и сходящимся (рис. 8.1а). Энергия электрона на стационарном уровне со значением главного квантового числа n, равного ∞, равна нулю (W∞= 0). Электрон, обладающий положительным значением энергии, покидает ядро, происходит ионизация атома.
В возбужденном состоянии атом может находиться ограниченное время. Из возбужденного состояния атом самопроизвольно переходит в состояние с меньшей энергией, излучая квант энергии с частотой
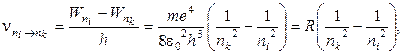 (8.7)
(8.7)
где 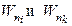 -энергия уровней, между которыми осуществляется переход, R= 3,29 ∙ 1015 с-1 – постоянная Ридберга (в спектроскопических исследованиях используют значение R'= R/c= 1,097 ∙ 107 м-1).
-энергия уровней, между которыми осуществляется переход, R= 3,29 ∙ 1015 с-1 – постоянная Ридберга (в спектроскопических исследованиях используют значение R'= R/c= 1,097 ∙ 107 м-1).
Спектр излучения атома водорода можно разбить на ряд групп (серий) спектральных переходов (рис. 8.1а и б). Совокупность переходов на состояния с энергией Wn= 1, образуют серию Лаймана. Для этой серии
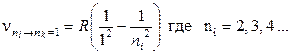
Если nк= 2, то возникает серия Бальмера:

Если nк= 3, то возникает серия Пашена:
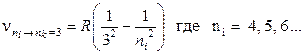
Учитывая, что длина волны спектрального перехода λ= с/v, нетрудно убедится, что серия Лаймана находится в ультрафиолетовой области спектра, линии серии Бальмера – в видимой области, а серии Пашена – в инфракрасной области спектра.
Теория Бора дала формулу, позволяющую объяснить спектр атомов водорода видимой области, известный к тому времени, предсказала существование спектров в ультрафиолетовой и инфракрасной областях, которые вскоре были обнаружены.
Дата добавления: 2015-08-08; просмотров: 997;
