Химические свойства. В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую π-систему
В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую π-систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О–Н увеличивается, водород ОН–группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как со щелочными металлами:
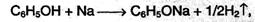
так и с их гидроксидами (отсюда старинное название «карболовая кислота»):
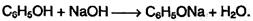
 Фенол – очень слабая кислота. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая:
Фенол – очень слабая кислота. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая:
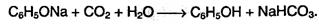
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используют хлорангидриды кислот:
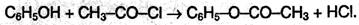
3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара -положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:
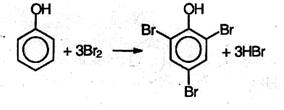
Взаимодействие с бромной водой – качественная реакция на фенол.
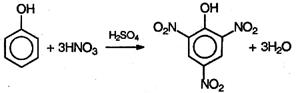
При нитровании фенола нитрующей смесью три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):
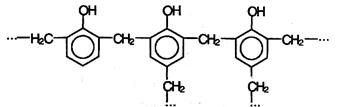
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола – высокомолекулярное соединение с разветвленной структурой типа:
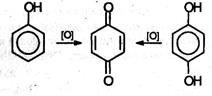
4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
Для идентификации фенола часто используют его реакцию с раствором FeCl3; при этом образуется комплексный ион фиолетового цвета – качественная реакция на обнаружение фенола.
Дата добавления: 2015-08-08; просмотров: 710;
