Как и в случае внутренних волосковых клеток, здесь отсутствуют десмосомы, промежуточные филаменты и щелевые контакты.
Плотные контакты в апикальной части клетки формируют уникальный смешанный комплекс с адгезионными контактами, разделяя среды, содержащие эндолимфу в scala media и перилимфу в опорно-волосковом клеточном пространстве. Актин образует кольцевое скопление по периферии клетки на уровне адгезионных контактов, связан с кутикулярной пластинкой, клеточной мембраной в области боковой поверхности и присутствует в околоядерной области.
Наружные волосковые клетки способны изменяться по высоте. Поскольку ретикулярная пластинка жестко фиксирована, изменение высоты наружных волосковых клеток преимущественно смещает базилярную мембрану с последующей передачей вибрации на стереоцилии внутренних волосковых клеток.
Эфферентные миелиновые волокна оливоулиткового тракта проходят через спиральный канал стержня (canalis spiralis modioli), в котором располагается улитковый узел (ganglion spirale), содержащий биполярные чувствительные нейроны. Эфферентные волокна теряют миелин и выходят из канала через продырявленный поводок (habenula perforata). Затем безмиелиновые эфферентные волокна пересекают туннель на уровне середины его высоты в отличие от афферентных волокон, которые пересекают туннель в области его дна. Эфферентные волокна проходят параллельно трём рядам наружных волосковых клеток, формируя наружные спиральные пучки. Выходящие из них отдельные нервные волокна формируют синапсы с наружными волосковыми клетками. Главным нейромедиатором в них считается ацетилхолин, проявляющий здесь тормозное действие. Молекулярная организация холинорецепторов в постсинаптической мембране уникальна. Они содержатa9 и a10 субъединицы. Секреция ацетилхолина вызывает гиперполяризацию наружных волосковых клеток, что оказывает модулирующее влияние на их высоту и последующие реакции в цепочке передачи звукового раздражения. Кроме того, ацетилхолин оказывает прямое влияние на высоту волосковых клеток, влияя на их жесткость по продольной оси. Изменение высоты волосковых клеток опосредовано внутриклеточными сигнальными путями, в которых участвуют ГТФазы RhoA, Rac1 и Cdc42. ГАМК, также как и ацетилхолин, оказывает гиперполяризующее действие на наружные волосковые клетки (рис. 8-61).
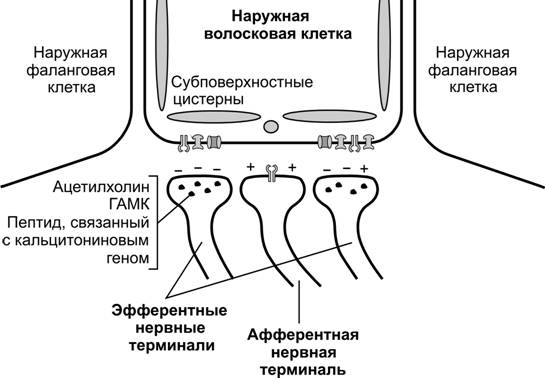
Рис. 8-61. Наружная волосковая клетка и её контакты с афферентными и эфферентными нервными терминалями. Клетку поддерживают наружные фаланговые клетки. Под мембраной боковой и базальной поверхности локализуются субповерхностные цистерны. Эфференты из оливокохлеарной системы образуют многочисленные синапсы с основанием наружной волосковой клетки в области залегания субповерхностных цистерн. Нейромедиаторами в эфферентном синапсе служат ацетилхолин и, возможно, ГАМК и пептид, связанный с кальцитониновым геном. В постсинаптической мембране, принадлежащей волосковой клетке, среди рецепторов к упомянутым лигандам присутствуют н-холинорецепторы (субъединицы a-9 и a-10), опосредующие тормозное влияние. Волосковая клетка и терминаль периферического отростка чувствительного нейрона тип II, локализованного в спиральном ганглии, образуют афферентный синапс с нейромедиатором глутаматом. [144]
Поддерживающие (опорные) клетки. Среди поддерживающих клеток различают внутренние фаланговые клетки, наружные фаланговые клетки, наружные пограничные столбчатые клетки, наружные поддерживающие столбчатые клетки, наружные поддерживающие кубические клетки, наружные базальные железистые клетки. Фаланговые клетки вступают в контакт с волосковыми, располагаясь на базилярной мембране. Отростки наружных фаланговых клеток проходят параллельно наружным волосковым клеткам, не соприкасаясь с ними на значительном протяжении, и на уровне апикальной части волосковых клеток вступают с ними в контакт. Поддерживающие клетки связаны щелевыми контактами, образованными коннексином-26, -30, -31 и -32. Щелевые контакты участвуют в восстановлении уровня К+ в эндолимфе в ходе следовых реакций после возбуждения волосковых клеток. Мутации гена коннексина-26 выявлены у больных врожденной нейросенсорной глухотой. Мутации ряда генов приводят к нарушению ионного гомеостаза в улитке и ослаблению слуха.
Поддерживающие клетки не только образуют опору волосковых клеток. Они участвуют в регуляции ионного гомеостаза в спиральном органе. Поддерживающие клетки выводят K+ из органа и передают эти ионы фиброцитам, которые, в свою очередь, участвуют в транспорте K+ в обратном направлении, в сосудистую полоску (stria vascularis). Мутации генов, кодирующих белки K+-каналов и K+/Cl– котранспортёра (например Kcc4) в поддерживающих клетках, являются причиной ухудшения слуха.
Маркёрами, отличающими поддерживающие клетки от волосковых, служат цитокератины и коннексины.
Наружная фаланговая клетка содержит три компартмента: тело, ножку и так называемую апикальную головную пластинку — боковой отросток в апикальной части. Тело клетки расположено на базилярной мембране. Верхняя часть образует округлое вместилище для базальной части наружной волосковой клетки. От тела клетки с наклоном отходит ножка в сторону ретикулярной пластинки, заполняющей пространство между наружными волосковыми клетками. Ножка заканчивается апикальной головной пластинкой, которая участвует в образовании ретикулярной пластинки. Головная пластинка наружных фаланговых клеток первого и второго ряда имеет гантелевидную форму. Если тело наружной фаланговой клетки образует чашу для наружной волосковой клетки, то её апикальная головная пластинка, располагаясь более латерально и апикально, не вступает в контакт с этой наружной волосковой клеткой, но контактирует с четырьмя другими наружными волосковыми клетками. Таким образом, каждая наружная фаланговая клетка находится в контакте с пятью наружными волосковыми клетками. Наружные фаланговые клетки, также как и наружные волосковые клетки, способны менять свою высоту, что осуществляется в ответ на действие АТФ через рецепторы P2X.
Наружные поддерживающие столбчатые клетки образуют латеральную границу спирального органа. Их цитоскелет более беден, чем в наружных фаланговых клетках и в клетках-столбах. Одна часть наружной поддерживающей столбчатой клетки расположена на базилярной мембране, тогда как другая часть формирует второй слой, располагаясь частично над наружными базальными железистыми клетками. Для апикальной части клетки характерны липидные включения.
Покровная мембрана (membrana tectoria) включает белки, углеводы, гликозаминогликаны, которые образуют матрикс и волокна. Среди белков наиболее значимы коллагены тип II и IX, а также коллагеноподобный белок типV. Неколлагеновые белки представлены преимущественно гликопротеинами. Описаны приводящие к глухоте мутации генов, кодирующих белки мембраны отогелин и a-текторин. В зоне прикрепления мембраны к спиральному краю выявлен белок отоанкорин. Его мутация приводит к глухоте. В составе мембраны присутствуют глюкоза, галактоза, манноза, N–ацетилглюкозамин, N–ацетилгалактозамин, N–ацетилнейраминовая кислота. Из гликозаминогликанов доминирует хондроитин-4-сульфат, но присутствуют и другие молекулы, например кератан-сульфат.
Базилярная мембрана представлена несколькими структурными доменами. Средняя часть — дугообразная зона (pars tecta). Латеральная часть представлена гребенчатой зоной (pars pectinata). Граница между ними проецируется на наружные опорные клетки. Дугообразная зона частично встроена в костную спиральную пластинку. Поэтому она менее мобильна при перемещении жидкостей улитки в ответ на звуковое раздражение. В противоположность ей гребенчатая зона более подвижна и вибрирует в ответ на звуковые сигналы. Через мелкие отверстия дугообразной зоны (habenula perforata) от спирального ганглия к волосковым клеткам спирального органа проходят волокна слухового нерва. Поверхность мембраны, обращенная к scala media, структурно организована по аналогии с базальной мембраной эпителия мембранного лабиринта. На противоположной поверхности, обращенной к перилимфе в scala tympani, присутствуют клетки, аналогичные клеткам, выстилающим барабанную лестницу, и внеклеточные компоненты. В образовании волокон участвуют коллагены II, IV и XI типа. Мутации коллагенов при синдроме Олпорта приводят к нарушению слуха. Во внеклеточном матриксе велико содержание фибронектина, а также присутствует тенасцин.
Путь передачи слухового раздражения. Цепочка передачи звукового давления выглядит следующим образом: барабанная перепонка ® молоточек ® наковальня ® стремя ® мембрана овального окна ® перилимфа ®базилярная и покровная мембраны ® мембрана круглого окна (рис. 8-62). При смещении стремени частицы перилимфы перемещаются по лестнице преддверия и затем через геликотрему по барабанной лестнице к круглому окну. Жидкость, сдвинутая смещением мембраны овального окна, создаёт избыточное давление в вестибулярном канале. Под действием этого давления базальный участок основной мембраны смещается в сторону барабанной лестницы. Колебательная реакция в виде волны распространяется от базальной части основной мембраны к геликотреме. Смещение покровной мембраны относительно волосковых клеток при действии звука вызывает их возбуждение. Смещение мембраны относительно сенсорного эпителия отклоняет стереоцилии волосковых клеток, что открывает механочувствительные каналы в клеточной мембране и приводит к деполяризации клеток. Возникающая электрическая реакция, названная микрофонным эффектом, по своей форме повторяет форму звукового сигнала.
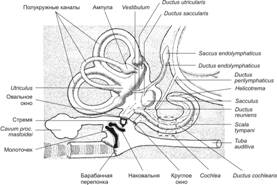
Рис. 8-62. Преддверно-улитковый орган(organum vestibulocochleare). Звуковое давление через барабанную перепонку по цепочке косточек среднего уха (молоточек наковальня стремя) передаётся на мембрану овального окна и далее к перилимфе сообщающихся через геликотрему лестниц к круглому окну. Колебания перилимфы передаются покровной мембране. Её смещение вызывает раздражение волосковых клеток. [17]
При сверхпороговом звуковом раздражении (акустическая травма) и применении некоторых ототоксических препаратов (антибиотики стрептомицин, гентамицин) волосковые клетки погибают. Возможность их регенерации из клеток–предшественниц нейросенсорного эпителия имеет важное практическое значение, считается установленным для птиц и интенсивно изучается на млекопитающих.
Дата добавления: 2015-07-07; просмотров: 2623;
