Расхождение теории теплоемкостей идеального газа с экспериментом.
Формулы для теплоемкости (9.10) и (9.13) дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных газов при комнатной температуре, например водорода, азота, кислорода и др. Для них теплоемкость оказывается весьма близкой к CV = 5/2R.
Однако у двухатомного газа хлора Cl2 теплоемкость равна примерно 6/2R, что невозможно объяснить (у двухатомной молекулы в принципе CV может быть равно либо 5/2R, либо 7/2R).
У трехатомных газов наблюдается систематические отклонения от предсказаний теории.
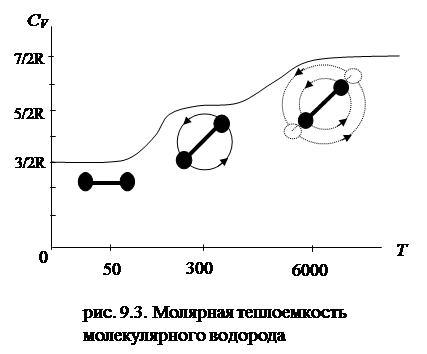 |
У жестких молекул трехатомных газов, если только молекулы не лежат на одной прямой, теплоемкость должна быть 6/2R. Эксперимент дает несколько большую величину, которую, однако, нельзя объяснить возбуждением какой-то дополнительной степени свободы. Эксперимент показал, что теплоемкость зависит от температуры, что находится в полном противоречии с формулами (9.10) и (9.13). Рассмотрим для примера более подробно теплоемкость молекулярного водорода. Молекула водорода двухатомна. Достаточно разреженный водородный газ очень близок к идеальному и является удобным объектом для проверки теории. Для двухатомного газа CV равно либо 5/2R, либо 7/2R, но от температуры теплоемкость не должна зависеть, однако в действительности теплоемкость молекулярного водорода зависит от температуры (рис.9.3): при низкой температуре (в области 50 К) его теплоемкость равна 3/2R, при комнатной — 5/2R, а при очень высокой температуре теплоемкость становится равной 7/2R. Таким образом, молекула водорода ведет себя при низкой температуре как точечная частица, у которой отсутствуют внутренние движения, при нормальной температуре — как жесткая гантель и наряду с поступательным движением также совершает вращательное движение, а при очень высокой температуре к этим движениям добавляются также колебательные движения атомов, входящих в молекулу. Дело происходит так как будто благодаря изменению температуры происходит включение (или выключение) различных степеней свободы: при малой температуре включены лишь поступательные, а затем и колебательные степени свободы.
Однако переход от одного режима движения к другому происходит не скачком при определенной температуре, а постепенно в некотором интервале температур. Это объясняется тем, что при определенной температуре возникает возможность для молекул переходить в другой режим движения. Но эта возможность не реализуется сразу всеми молекулами, а лишь их частью. По мере изменения температуры все большая доля молекул переходит в другой режим движения и поэтому кривая теплоемкости изменяется плавно в некотором интервале температур.
При достаточно малой температуре движение молекулы водорода между столкновениями подобно поступательному движению твердого тела.
Когда температура повышается, включаются вращательные степени свободы и картина движения молекулы несколько изменяется — молекула в процессе прямолинейного движения между столкновениями вращается.
При дальнейшем повышении температуры включаются колебательные степени свободы и движение молекулы еще более усложняется, поскольку в процессе поступательного движения составляющие ее атомы колеблются вдоль оси, изменяющей свою ориентацию в пространстве.
Объяснить зависимость теплоемкости от температуры классической теории не удалось. Количественную характеристику зависимости, обусловленной квантовыми закономерностями движения, можно дать лишь на основе решения уравнений движения квантовой механики.
Дата добавления: 2015-08-08; просмотров: 1536;
