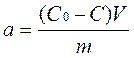Критерии самопроизвольного протекания химического процесса. Энергия Гиббса
Итак, имеем два критерия возможности самопроизвольного протекания химического процесса – изменение энтальпии DН, которое отражает взаимодействие атомов, образование химических связей, то есть определенное упорядочение системы и изменение энтропии DS, которое отражает противоположную тенденцию к беспорядочному расположению частиц. Если DS=0, то движущей силой процесса будет стремление системы к минимуму внутренней энергии, то есть критерий процесса – уменьшение энтальпии или DН<0.
Если DН=0, то критерий самопроизвольного протекания процесса DS>0.
Чтобы иметь возможность количественно сопоставить эти два критерия, нужно, чтобы они выражались в одинаковых единицах (DН – кДж, DS – Дж/К). Очевидно, чтобы выразить энтропийный фактор в единицах энергии, его нужно домножить на температуру. Это тем более логично, что повышение Т способствует увеличению беспорядка в системе. Тогда ТDS – энтропийный фактор процесса, DН – энтальпийный. В состоянии равновесия оба этих фактора должны быть равны:
DН= ТDS . (8.12)
Это уравнение универсально, оно относится и к равновесию жидкость – пар и к другим фазовым превращениям, а также к химическим реакциям. Благодаря этому равенству можно рассчитать изменение энтропии в равновесном процессе, так как при равновесии:
DН/Т = DS .
Однако нас интересует количественный критерий принципиальной возможности протекания процесса. В механике критерий падения тела это уменьшение его гравитационного потенциала, который не зависит от пути перемещения тела. По аналогии химический процесс можно охарактеризовать своим потенциалом, который должен уменьшаться в ходе самопроизвольного процесса. Этот потенциал при постоянной температуре и давлении принято называть изобарно – изотермическим потенциалом Гиббса G. Убыль этого потенциала не зависит от пути процесса и равна максимальной работе, которую можно получить, переходя от данного состояния к равновесному (за вычетом работы против внешнего давления).
-DG=Wрmax . (8.13)
То есть энергия Гиббса – это часть энергетического эффекта химической реакции, которую можно превратить в работу, ее называют свободной энергией.
В таком случае условием возможности протекания процесса будет DG<0, но поскольку в состоянии равновесия DG=0, то из уравнения (1) получаем:
DG=DН - ТDS , (8.14)
Таким образом, мы определяем G=Н – ТS и можем нарисовать его изменение в ходе процесса (рисунок 8.5):
А«В,
где А – исходные вещества;
В – продукты реакции.
В левой части графика (8.5) – уменьшение значения G, идет прямая реакция. Для нее DG<0. Справа от положения равновесия идет обратная реакция, для нее DG<0. В состоянии равновесия DG=0.
Как влияют величины энтальпийного и энтропийного фактора на протекание процесса?
DG=DН - ТDS
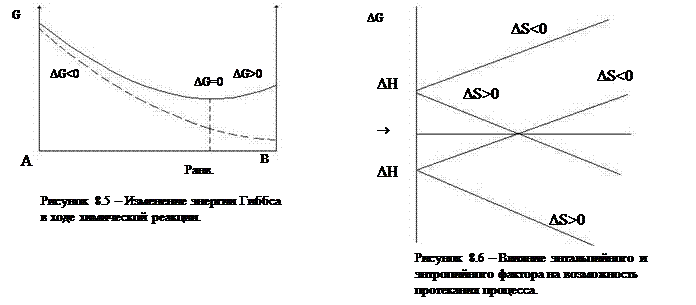
Возможны следующие случаи (рисунок 8.6):
1) экзотермическая реакция, DН<0:
а) DS>0, тогда для любого Т DG будет меньше нуля и процесс идет всегда, причем до конца;
б) DS<0, в этом случае все будет зависеть от соотношения абсолютных значений энтальпийного и энтропийного фактора, DG<0 – реакция идет, DG>0 – реакция не идет.
Экзотермические реакции, сопровождаются уменьшением энтропии, идут при низких температурах, увеличение Т способствует протеканию обратной реакции (Принцип Ле Шателье).
2) Эндотермическая реакция, DН>0:
а) DS>0, реакция возможна только если | ТDS|>|DН|, тогда DG>0, то есть при высоких температурах;
б) если же, DS<0, то DG>0 при любых температурах и процесс самопроизвольно идти не может.
Пример – реакция окисления глюкозы до CO2 и H2O:
С6Н12О6 + 6О2 ®6СО2 + 6Н2О DН= - 2810 кДж .
Энтропия при этом, очевидно, возрастает. Следовательно, обратный процесс принципиально не может идти самопроизвольно. Для его протекания требуется энергия извне (фотосинтез).
Следует отметить, что в вопросе о возможности протекания процесса термодинамический критерий – истина в последней инстанции. Если изменение значения энергии Гиббса положительные DG>0, никакие катализаторы не помогут провести процесс. При изменении значения энергии Гиббса отрицательные DG<0 процесс может быть заморожен.
До сих пор рассматривали процессы, протекающие при постоянном давлении. Если обратиться к процессам, протекающим при постоянном объеме, получим другое значение термодинамического потенциала – потенциал Гельмгольца:
DF = DU - ТDS , (8.15)
Для решения вопроса о возможности протекания процесса, для расчетов энергии Гиббса DG необходимо установить, от чего она зависит и стандартизировать ее.
Значении DН зависит от температуры и давления и в первом приближении мы считаем, что эта зависимость незначительна и пользуемся стандартными значениями DН°. значение DS кроме давления и температуры зависит еще от концентрации (S=S° - RlnC), следовательно, значение DG также будет зависеть от концентрации реагирующих веществ, а они в ходе процесса меняются. Рассмотрим эту зависимость.
аА®bВ (для простоты)
DG=DН - ТDS, как для всякой реакции.
Считая, что DН слабо зависит от Т, DН = DН° = bDН°f(B) - aDН°f(A),
DS = bS(B) – aS(A) = b(S°B – Rln(B)) – a(S°A – Rln(A)),
Перегруппировав и вспомнив свойства логарифмов получим:
DS= S° - Rln(Bb/Aa) ,
Подставив в уравнение для DG, получим
DG=DН° - ТDS° + Rln(Bb/Aa) = DG + RTln(Bb/Aa), (8.16)
Это уравнение изотермы Вант-Гоффа.
где DG°=DН° - ТDS° - термодинамический потенциал, определенный для единичных концентраций или для чистых веществ, то есть стандартный термодинамический потенциал - он определен для единичных концентраций начальных и конечных веществ и для общего давления 1 атм, но может быть разным для разных температур.
Вопросы для самоконтроля
1. Какие реакции называются: а) экзотермическими; б) эндотермическими?
2. Что называется тепловым эффектом реакции? В каких единицах он выражается?
3. Что называется энтальпией? Какой знак имеет изменение энтальпии для экзотермических реакций и эндотермических реакций?
4. Какие условия называются стандартными?
5. Как формулируется закон Гесса?
6. Что называется теплотой образования вещества? Сформулируйте первое следствие из закона Гесса.
7. Что называется теплотой сгорания вещества? Сформулируйте второе следствие из закона Гесса.
8. Сформулируйте третий закон термодинамики.
9. Что такое фаза химической системы?
10. Как называются функции состояния системы и от чего они зависят?
11. В результате каких процессов внутренняя энергия системы увеличивается? Какой знак будет иметь работа, если Q = 0 ?
12. Увеличится ли внутренняя энергия системы, если Q = 0 и W= 0?
13. К системе подведена теплота 200 кДж, система совершила работу против действия внешних сил, равную 150 кДж. На какую величину изменилась внутренняя энергия системы? Какой знак имеет Δ U?
14. Приведите два пути окисления серы до SO3. Составьте энтальпийную диаграмму процесса.
15. Газовые выбросы тепловых станций и двигателей внутреннего сгорания содержат оксиды азота. Реакции их образования очень сложны, но в наиболее простом виде их можно представить уравнениями:
a) ½ N2 + ½ O2 = NO.
6) NO + ½ O2 = NO2.
Определите стандартные энтальпии этих реакций при 298 К и укажите, какая и: них - эндотермическая, какая - экзотермическая.
16. Термитная смесь состоит из порошка алюминия и Fe2O3. Запишите уравнение реакции между этими веществами и рассчитайте энтальпию этой реакции.
17. Приведите примеры самопроизвольных процессов, сопровождающихся понижением энтальпии системы (экзотермических процессов).
18. Приведите примеры самопроизвольных процессов, сопровождающихся переходом системы из более упорядоченного в менее упорядоченное состояние.
19. Какой знак имеет энтропия процессов: а) сублимации иода; б) перехода белого олова в серое?
20. Можно ли предсказать влияние температуры на направление химической реакции, если известна ее энтальпия? Ответ подтвердите на примере какой-либо реакции.
22. Возможно ли самопроизвольное окисление азота по уравнению:
½ N2 + О2 = NO2
при стандартных состояниях N2, O2, и NO2, при 298 К и других температурах? Ответ подтвердите расчетом.
23. В чем разница между энергией Гиббса и стандартной энергией Гиббса химической реакции?
|
Дата добавления: 2015-08-08; просмотров: 5357;