Жидкое состояние вещества
В жидком состоянии расстояние между частицами значительно меньше, чем в газообразном. Частицы занимают основную часть объема, постоянно соприкасаясь друг с другом и притягиваются друг к другу. Наблюдается некоторая упорядоченность частиц (ближний порядок). Частицы подвижны относительно друг друга.
В жидкостях между частицами возникают вандерваальсовы взаимодействия: дисперсионные, ориентационные и индукционные. Небольшие группы частиц, объединенных теми или иными силами, называются кластерами. В случае одинаковых частиц кластеры в жидкости называются ассоциатами
В жидкостях при образовании водородных связей увеличивается упорядочение частиц. Однако водородные связи и вандерваальсовы силы непрочны – молекулы в жидком состоянии находятся в непрерывном хаотическом движении, которое получило название броуновского движения .
Для жидкого состояния справедливо распределение молекул по скоростям и энергиям Максвелла-Больцмана.
Теория жидкостей разработана гораздо хуже, чем газов, поскольку свойства жидкостей зависят от геометрии и полярности взаимно близко расположенных молекул. Кроме того, отсутствие определенной структуры жидкостей затрудняет их формализованное описание – в большинстве учебников жидкостям уделено гораздо меньше места, чем газам и твердым кристаллическим веществам.
Между жидкостями и газами нет резкой границы – она полностью исчезает в критических точках. Для каждого газа известна температура, выше которой он не может быть жидким ни при каком давлении; при этой критической температуре исчезает граница (мениск) между жидкостью и ее насыщенным паром. Существование критической температуры ("температуры абсолютного кипения") установил Д.И.Менделеев в 1860 г
Таблица 7.2 - Критические параметры (tк, pк, Vк) некоторых веществ
| Вещество | tк, оС | pк, атм | Vк, см3/моль | tплавлоС | tкипоС |
| He | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78,48(субл) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Давление насыщенных паров – парциальное давление, при котором скорости испарения и конденсации пара равны :
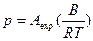 , (7.6)
, (7.6)
где А и В – константы.
Температура кипения – температура, при которой давление насыщенных паров жидкости равно атмосферному давлению.
Жидкости обладают текучестью – способность к перемещению под действием небольших сдвигающих усилия; жидкость занимает объем , в который ее помещают.
Сопротивление жидкости текучести получило название вязкости, 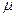 [Па . с].
[Па . с].
Поверхностное натяжение [Дж/м2 ] – работа, необходимая для создания единицы поверхности.
Жидкокристаллическое состояние – вещества в жидком состоянии, обладающие высокой степенью упорядочности, занимают промежуточное положение между кристаллами и жидкостью. Они обладают текучестью, но в то же время имеют дальний порядок. Например – производные коричневой кислоты, азолитинов, стероидов.
Температура просветления – температура, при которой жидкие кристаллы (жк) переходят в обычное жидкое состояние.
7.5 Твёрдые вещества
В твёрдом состоянии частицы настолько сближаются друг с другом, что между ними возникают прочные связи, отсутствует поступательное движение и сохраняются колебания около своего положения. Твёрдые вещества могут находиться в аморфном и кристаллическом состоянии.
7.5.1 Вещества в аморфном состоянии
В аморфном состоянии вещества не имеют упорядоченной структуры.
Стеклообразное состояние – твердое аморфное состояние вещества, которое получается в результате глубокого переохлаждения жидкости. Это состояние неравновесно, однако стекла могут существовать длительное время. Размягчение стекла происходит в некотором диапазоне температур – интервале стеклования, границы которого зависят от скорости охлаждения. С увеличением скорости охлаждения жидкости или пара возрастает вероятность получения данного вещества в стеклообразном состоянии.
В конце 60-х годов XX века получены аморфные металлы (металлические стекла) – для этого потребовалось охлаждать расплавленный металл со скоростью 106 - 108 град/с. Большинство аморфных металлов и сплавов кристаллизуются при нагреве свыше 300оС. Одно из важнейших применений – микроэлектроника (диффузионные барьеры на границе металл-полупроводник) и магнитные накопители (головки ЖМД). Последнее – благодаря уникальной магнитомягкости (магнитная анизотропия меньше на два порядка, чем в обычных сплавах).
Аморфные вещества изотропны, т.е. имеют одинаковые свойства во всех направлениях.
7.5.2 Вещества в кристаллическом состоянии
Твердые кристаллические вещества обладают упорядоченной структурой с повторяющимися элементами, что позволяет исследовать их методом дифракции рентгеновских лучей (метод рентгеноструктурного анализа, используется с 1912 г.
Монокристаллы (одиночные соединения) характеризуются анизотропностью – зависимость свойств от направления в пространстве.
Регулярное расположение частиц в твёрдом теле изображается в виде кристаллической решётки. Кристаллические вещества плавятся при определённой температуре, называемой температурой плавления.
Кристаллы характеризуются энергией, постоянной кристаллической решётки и координационном числом.
Постоянная решётка характеризует расстояние между центрами частиц, занимающих узлы в кристалле, в направлении характеристических осей.
Координационным числом обычно называется число частиц, непосредственно примыкающих к данной частице в кристалле (смотри рисунок 7.2 – координационное число восемь и по цезию и по хлору)
Энергией кристаллической решётки называют энергию, необходимую для разрушения одного моля кристалла и удаления частиц за пределы их взаимодействия.
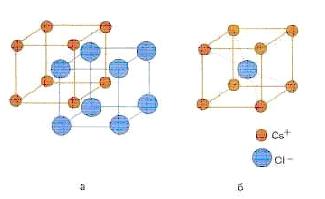
Рисунок 7.2 - Строение кристалла хлористого цезия CsCl (а) и объемноцентрированная кубическая элементарная ячейка этого кристалла (б)
7.5.3 Кристаллические структуры
Наименьшей структурной единицей кристалла, которая выражает все свойства его симметрии, является элементарная ячейка. При многократном повторении ячейки по трём измерениям получают кристаллическую решётку.
Имеется семь основных ячеек: кубическая, тетраэдрическая, гексагональная, ромбоэдрическая, орто ромбоэдрическая, моноклинная и триклинная. Имеется семь производных о основных элементарных ячеек, например объёмно центрированная, кубическая гранецентрированная.
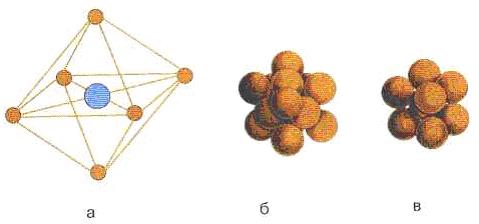
а - элементарная ячейка кристалла NaCl; б - плотная гранецентрированная кубическая упаковка NaCl; в- объемноцентрированная кубическая упаковка кристалла CsCl Рисунок Рисунок 7.3 - Элементарная ячейка
Изоморфные вещества – вещества близкой химической природы, образующие одинаковые кристаллические структуры: CaSiO4 и MgSiO4
Полиморфизм–соединения, существующие в двух и более кристаллических структурах, например SiO2 (в виде гексагонального кварца, ромбического тридимита и кубического кристобаллита.)
Аллотропные модификации – полиморфные модификации простых веществ, например, углерод: алмаз, графит, карбин, фуллерен.
По природе частиц в узлах кристаллической решётки и химических связей между ними кристаллы подразделяются на:
1) молекулярные – в узлах находятся молекулы, между которыми действуют вандерваальсовы силы, имеющие невысокую энергию: кристаллы льда;
2) атомно – ковалентные кристаллы – в узлах кристаллов располагаются атомы, образующие друг с другом прочные ковалентные связи, обладают высокой энергией решётки, например, алмаз (углерод);
3) ионные кристаллы – структурными единицами кристаллов этого типа являются положительно и отрицательно заряженные ионы, между которыми происходит электрическое взаимодействие, характеризуемое достаточно высокой энергией, например NaCL, KCL;
4) металлические кристаллы – вещества, которые обладают высокой электропроводимостью, теплопроводимостью, ковкостью, пластичностью, металлическим бликом и высокой отражательной способностью по отношению к свету; связь в кристаллах металлическая, энергия металлической связи является промежуточной между энергиями ковалентных и молекулярных кристаллов;
5) кристаллы со смешанными связями – между частицами существуют сложные взаимодействия, которые можно описать наложениям двух или более видов связей друг на друга, например клатраты (соединения включены) – образованы включением молекул (гостей) в полости кристаллического каркаса, состоящего из частиц другого вида (хозяев): газовые клатраты CH4.6H2O, клатраты мочевины.
Дата добавления: 2015-08-08; просмотров: 2372;
