Химические системы
Агрегатные состояния вещества
Вещества, в зависимости от внешних условий, могут находиться в трёх физических состояниях : газообразном, жидком и твёрдом. При очень высоких температурах возникает особая разновидность газообразного состояния – плазма.
Простейшие определения
газы не имеют постоянного объёма и формы при постоянной температуре;
жидкости имеют постоянный объём, но форма зависит от формы сосуда;
твёрдые вещества имеют постоянную форму и объём.
Химические системы
Системойназывается совокупность находящихся во взаимодействии веществ или частиц, мысленно или фактически обособленная от окружающей сферы. Всё, что находится вне системы, называется внешней средой. Различают гомогенные и гетерогенные системы. Гомогенныесистемы состоят из одной фазы, гетерогенныесистемы из двух или более фаз.
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы поверхностью раздела. Внутри одной фазы свойства могут изменяться непрерывно, но на поверхности раздела между фазами свойства меняются скачком. Пример двухфазной системы – поверхность реки в ледоход.
Компонентами называют вещества, минимально необходимые для составления данной системы (минимум один). Число компонентов в системе равно числу веществ в ней присутствующих, минус число связывающих эти вещества независимых уравнений.
Компонентом называют вещество, которое может быть выделено из данной системы и количество которого можно менять (хотя бы в некоторых пределах) независимо от других.
Если в системы входят вещества или частицы, способные к химическому взаимодействию, то эти системы называются химическими системами.
Дисперсные системы – гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Одна из фаз образует непрерывную дисперсионную среду, в которой распределена дисперсная фаза в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков.
Грубодисперсные системы имеют размеры частиц выше 1 мкм, (удельная поверхность не более 1 м2 /г), тонко(высоко)дисперсные или коллоидные системы содержат частицы от 1 нм до 1 мкм (удельная поверхность – сотни м2 /г).
По агрегатному состоянию делят на:
газодисперсионные – аэрозоли (дымы, пыли, туманы), порошки, волокнистые материалы;
жидкодисперсионные с твердой дисперсной фазой– грубодисперсные суспензии и пасты, высокодисперсные золи и гели;
жидкодисперсионные с жидкой дисперсной фазой – грубодисперсные эмульсии, высокодисперсные эмульсии и латексы;
жидкодисперсионные с газовой дисперсной фазой – грубодисперсные газовые эмульсии и пены;
твердодисперсионные – например, рубиновые стекла, минералы типа опала, микропористые материалы.
Золи (нем. ед.ч. Sol) (лиозоли, коллоидные растворы) – высокодисперсные коллоидные системы с жидкой дисперсионной средой. Частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из молекул (ионов) дисперсионной среды называют мицеллами. Размер частиц лиозоля в пределах 10-7 – 10-5 см.
Золь – коллоидно-дисперсная система с изолированными друг от друга, а гель – с соприкасающимися (агрессивными) коллоидными частицами; суспензия – грубодисперсная система с относительно малой, а паста – большой концентрацией дисперсной фазы.
Студни – системы полимер-растворитель, характеризующиеся большими обратимыми деформациями при практически полном отсутствии вязкого течения. Иногда используют термин "гели", который в коллоидной химии обозначает скоагулированные золи.
Наиболее важны студни на основе сетчатых полимеров с разной степенью поперечной сшитости. При изменении температуры и давления возможен синерезис – отделение части жидкости.
Студни на основе сополимеров акриловой кислоты и акриламида используют для создания мембран с регулируемой проницаемостью, депо для лекарств в организме, в качестве сорбентов и как модели в биологических исследованиях.
Химические системы характеризуются определёнными параметрами (давление, температура, объём, масса и концентрация) и существуют при определённых условиях.
Температура. Температура характеризует степень нагретости тела. В научных исследованиях абсолютная шкала температур по цельсию 0С: Т = 273,15 + t,0С.
Сравнение свойств различных веществ проводят при одной - стандартной температуре, равной 2730 К (00 С).
Давление – нормальное напряжение, возникающее в жидкости от действия внешних сил : 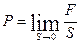 (7.1)
(7.1)
В международной системе (СИ), единицей измерения давления является Паскаль (Па), или 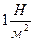 ; 1атм = 101325 Па.
; 1атм = 101325 Па.
Стандартным давлением газа считалось 101,325 кПа. В 1984г. международный Союз чистой и прикладной химии рекомендовал в качестве стандартного р = 100 кПа (1 бар.) Таким образом, стандартными условиями являются температура 2730 к (00С) и давление 100 кПа.
Удельным объёмом называется объём единицы веса :
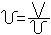 [
[ 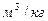 ] (7.2)
] (7.2)
Концентрация–отношение количества или массы вещества, содержащегося в системе, к объёму или массе этой системы называют концентрацией.
Молярная концентрация вещества– отношение количества вещества (в молях), содержащегося в системе, к объёму этой системы. [моль/м3, моль/л]
Молярная доля вещества–отношение количества вещества данного компонента ( в молях), содержащегося в системе, к общему количеству вещества (в молях) – выражается в долях единицы, % – сотая доля процента, промилле (%0) – тысячная часть и в миллионных долях (млн-1) или ррm.
Объёмная доля вещества - отношение объёма компонента, содержащегося в системе, к общему объёму системы – выражается в долях единицы, процентах, промилле или в миллионных долях.
Массовая доля вещества– отношение массы данного компонента, содержащегося в системе, к общей массе этой системы – выражается в долях единицы, процентах, промилль и миллионных долях.
Моляльная концентрация – количество молей вещества, содержащегося в 1000г. растворителя.
Дата добавления: 2015-08-08; просмотров: 1379;
