Природа химической связи в комплексах. Структура и свойства комплексных соединений
Для объяснения образования химических связей в комплексах используется как метод валентных связей, так и метод молекулярных орбиталей. Кроме того для объяснения природы связей и свойств комплексных соединений применяется электростатическая теория кристаллического поля. Многие свойства комплексных соединений можно объяснить с позиции метода валентных связей, который и будет использован в данном учебнике.
Метод валентных связей.(ВС)
Согласно методу ВС между комплексообразователем и лигандами возникают ковалентные связи по донорно-акцепторному механизму. Комплексообразователь предоставляет на связь валентные орбитали, а лиганды- неподеленные пары электронов. Рассмотрим образование химических связей в комплексах 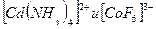
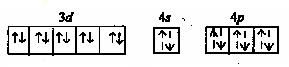
У иона кадмия на внешней оболочке имеются вакантные 4s- и 4p- орбитали:
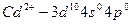
 .
.
У атомов азота в молекуле аммиака имеются неподеленные пары электронов:
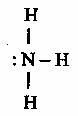 .
.
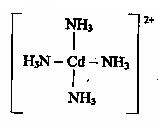
При их взаимодействии образуется комплексный ион
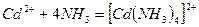
Обозначим электрон на орбиталях, занятых по донорно-акцепторному механизму пунктирными стрелками. Тогда электронную конфигурацию комплекса можно представить в виде:
 ,
,
 .
.
Как видно, в этом случае в образовании связей участвуют одна s- и три p- орбитали, которые гибритизируются(sp3), поэтому комплексный ион будет иметь тетраэдрическое строение.
У иона Со  на внешней оболочке имеются вакантные 4s-, 4p- ,4d- орбитали:
на внешней оболочке имеются вакантные 4s-, 4p- ,4d- орбитали:
Со  - 3d
- 3d 
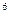 4s
4s 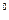 4p 4d
4p 4d 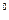
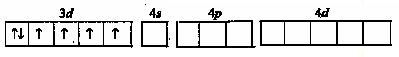 .
.
Фторид- ионы имеют неподеленные пары электронов
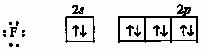 .
.
При взаимодействии F  и Со
и Со  образуется комплексный ион[CoF
образуется комплексный ион[CoF  ]
]  , в котором шесть лигандов F
, в котором шесть лигандов F  образуют шесть ковалентных связей по донорно-акцепторному механизму
образуют шесть ковалентных связей по донорно-акцепторному механизму

Как видно, при образовании комплекса происходит sp 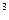 d
d 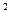 - гибридизация и соответственно полученный комплекс имеет тетраэдрическую структуру.
- гибридизация и соответственно полученный комплекс имеет тетраэдрическую структуру.
Некоторые лиганды или их атомы также могут иметь вакантные орбитали, например РН 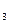 , H
, H 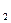 S. В этом случае образуются дополнительные связи по донорно- акцепторному механизму (дативные связи), в которых лиганд служит акцептором, а комплексообразователь, имеющий неподеленные пары электронов,- донором. Образование дативных связей приводит к увеличению прочности комплексов.
S. В этом случае образуются дополнительные связи по донорно- акцепторному механизму (дативные связи), в которых лиганд служит акцептором, а комплексообразователь, имеющий неподеленные пары электронов,- донором. Образование дативных связей приводит к увеличению прочности комплексов.
Метод ВС является относительно простым и наглядным и позволяет объяснить структуру и свойства многих комплексов. Однако, он не пригоден для описания систем с многоцентровыми связями, не объясняет оптические и другие свойства комплексов.
Вопросы для самоконтроля
1. Укажите, какие виды вандерваальсовых сил существуют в жидких СО2, С12 иH2S?
2. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом изследующих веществ: О2, Н2О2 и Н2О?
3. Объясните закономерности изменения температуры плавления в ряду:
СH4 (-182,5°С), NН3 (-77,7°С), Н2О (0°С)
4. Что проедставляет собой донорно-акцепторное взаимодействие молекул?
5. В чем заключается координационная теория Вернера.
6. Приведите определения следующих понятий: комплекс, лиганды, комплексообразователи, координационное число и заряд комплекса.
7. Определить степень окисления железа в комплексе [Fe(CN)6]4–. Напишите его название.
8. Запишите формулу комплексного соединения трис(этилендиамин)кобальта (III).
9. Запишите формулу комплексного соединения гексацианоферрата(III) калия.
10. Используя в качестве лигандов Cl–, напишите комплексы с Pt(II) и Pt(IV) и дайте им названия.
11. Пероксид водорода имеет температуру плавления -0,4°С и кипения +150°С и
высокую вязкость. Электрический момент диполя молекулы 2,25 D. Объясните причину таких высоких значений температур плавления и кипения, а также высокой
вязкости. Какие взаимодействия могут быть между молекулами Н2О2? Приведите
схемы связей.
Дата добавления: 2015-08-08; просмотров: 1462;
