Структура периодической системы и ее связь с электронной структурой атомов
Периодическая система элементов состоит из периодов, групп и подгрупп. Периодом называется последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2 np6. В системе имеется 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Группы делятся на главные и побочные подгруппы. К главным подгруппам относятся подгруппы элементов второго периода и подгруппа благородных газов. К побочным подгруппам принадлежат d- и f- элементы.
Первый период состоит из двух элементов: водорода и гелия. Электрон, который последним заполняет орбитали атома называется формирующим, и элемент относится к группе, называемой по формирующему электрону. В данном случае оба элемента имеют формирующие s –электроны и соответственно называются s – элементами.
У элементов второго периода формируется L –оболочка, заполняются s- и p- подоболочки.
Третий период начинается с натрия и заканчивается аргоном. Хотя в третьем уровне (оболочка М) имеется подоболочка 3 d, которая остается незаполненной, в четвертом периоде начинает формироваться следующая оболочка N (n = 4) и период начинается с s- элемента калия. Это обусловлено тем, что энергия подуровня 4s несколько ниже, чем энергия подуровня 3d. После заполнения 4s- подоболочки заполняется 3d- подоболочка. Четвертый период завершается формированием подоболочки 4р у криптона (Kr). Всего в четвертом периоде 18 элементов.
Пятый период аналогичен четвертому периоду. В шестом периоде, как и в пятом. После заполнения s– подоболочки начинается формирование d- подоболочки предвнешнего уровня у лантана. Затем продолжается заполнение оставшихся орбиталей в 5d-подоболочке и 6р- подоболочке. Период завершает радон (Rn). Этот период имеет 32 элемента: 2 s-элемента, 6 р- элементов, 10 d- элементов и 14 f- элементов. Седьмой период начинается и продолжается аналогично шестому периоду, однако формирование его не завершено.
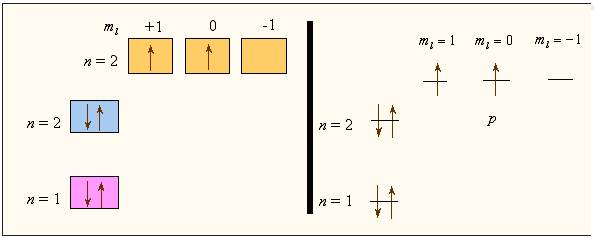
Возьмем атом водорода H. z=1, 1e Электронная конфигурация 1s1; следующий атом гелия Не - z=2, электронная конфигурация 1s2. Уровень с главным квантовым числом 1 заполнен, надо заполнять следующий слой с n=2, т.е. начинать новый период.
Во втором периоде заполняем 2s и 2p орбитали, их четыре, их емкость 8e. Во втором периоде как раз восемь элементов от лития Li до неона Ne 1s2 2s2 2p6. Начинаем следующий, третий период - n=3. Натрий Na:[Ne]3s1, …. аргон Ar:[Ne]3s23p6. Далее по правилу Клячковского мы должны заполнять не 3d, а 4s уровень, т.е. начинать новый период. Калий K:[Ar]4s1, кальций Ca:[Ar]4s2. Теперь начинается заполнение 3d подоболочки 3d орбиталей, их пять, следовательно таких d-элементов окажется десять. Скандий Sc: 3d14s2, …. цинк Zn: 3d104s2. Следует только учесть два обстоятельства:
1). Электронные конфигурации атомов хрома и меди:
Хром Cr: вместо [Ar]3d44s2 - 3d54s1, медь Cu: вместо [Ar]3d94s2 - 3d104s1. Это связано с особой устойчивостью полузаполненных и полностью заполненных электронных оболочек. Такое явление получило название провала электронов с s- на d- подоболочку. Такой провал наблюдается и у Nb (ниобия), Mo (молибдена), Pt (платины), Pd (палладия).
2). Хотя заполняется сначала 4s, а потом 3d орбиталь, при ионизации первыми уходят именно s-электроны. Co: 3d74s2 ® Co2+: 3d74s0.
Закончив заполнять 3d-орбиталь, переходим к 4p (n+l=5) и добираемся до криптона Kr: [Ar]3d104s24p6. Дальше ситуация повторяется с d-электронами и f-электронами - 4d n+l=6, 4f n+l=7, в то время как 5s n+l=5. Сначала заполняется 5s (рубидий Rb, стронций Sr), затем 4d (иттрий Y – кадмий Cd), и наконец 5p (n+l=7, как и у 4d). Закончили на ксеноне Xe: 4d105s25p6. Теперь приходится заполнять 6s орбиталь, у нее n+l=6, меньше, чем у 5d и 4f. После лантана La: 5d16s2 начинается заполнение 4f орбиталей и мы получаем 14 лантанидов.
Все остальные электронные конфигурации студенты могут написать сами.
|
| Рисунок 4.1 - Электронное строение атома углерода |
Основные понятия, необходимые для изучения реакционной способности и химической связи
1. Потенциал ионизации Ii - мера подвижности электронов в атоме. Энергия, которую необходимо затратить для полного удаления электрона с атома. Ii возрастает по мере увеличения i, поскольку последующие электроны удаляются с положительно заряженного иона. Первый потенциал ионизации соответствует положению последней занятой орбитали на шкале энергии. Энергию ионизации выражают либо в килоджоулях на моль (кДж/моль), либо в электроновольтах (эВ).
Примеры: Li 1s22s1 I1 = 5.39 эВ
I2 = 75.62 эВ
Be 1s22s2 I1 = 9.32 эВ
I2 = 18.21 эВ
I3 = 153.85 эВ
Э0 + I = Э+ + е-
I1<I2<I3
2. Остов и валентные электроны. Валентность это, вообще говоря, способность атома образовывать химические связи. Как видно из примеров, наиболее подвижны электроны, находящиеся на последнем электронном уровне, в верхнем слое - они называются валентными электронами. Все остальное - электроны остова, они неохотно и редко участвуют в химической связи.
3. Основное и возбужденное состояние: пример - Be 1s22s2 - основное состояние; 1s22s12p1 - возбужденное состояние.
4. Сродство к электрону Eср - энергия, которая выделяется при присоединении к атому одного электрона Э + e = Э-. Не может быть положительного сродства ко второму электрону - он добровольно не сядет на отрицательный ион.
5. Электроотрицательность (ЭО) - способность атомов притягивать к себе электроны (но не сажать на свои электронные оболочки). Измерить, судя по определению, трудно. Поэтому существуют разные шкалы электроотрицательностей. Например: шкала Малликена c=1/2(I1 + Eср), по Полингу фтор обладает самой большой электроотрицательностью - 4, остальные элементы определяются относительно cF.
6. Атомные радиусы – не имеют строго определенных границ из-за корпускулярно-волнового характера электронов. Можно условно принять за радиус атома теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электронной плотности или половину расстояния между центрами двух смежных атомов в кристаллах.
Дата добавления: 2015-08-08; просмотров: 597;
