Основные закономерности изменения свойств элементов и их соединений в периодической таблице Д.И. Менделеева
Периодичность изменения свойств легко продемонстрировать, двигаясь вдоль периода: Li - металл, далее металлические свойства убывают и фтор - неметалл, не говоря уже об инертных газах. Добавив еще один положительный заряд к ядру, опять получаем металл - натрий, свойства которого очень схожи со свойствами Li. Однако, даже в пределах периода, некоторые свойства меняются немонотонно. Пример: изменение первого потенциала ионизации.
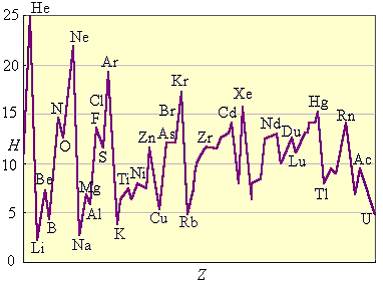
Рисунок 4.2 – Изменение потенциала ионизации попериодам
От лития к неону I1 должен возрастать, поскольку увеличивается заряд ядра атомов и притягивание электронов. Это в общем и наблюдается. См. выше. Но при переходе от Be к B наблюдается падение I1. Причина - удаляется p-электрон, уровень которого выше на шкале энергии, чем у s-электрона. При переходе от N к O также наблюдается уменьшение I1. Это связано с удалением спаренного электрона с атома кислорода. Спаривание - процесс невыгодный, на него затрачивается энергия (см. правило Гунда). Удалить такой электрон энергетически дешевле.
Наблюдаемая немонотонность свойств элементов в пределах периода называется “внутренней периодичностью”
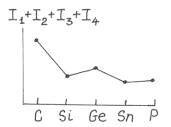
Рисунок 4.3 – Изменение суммы потенциалов ионизации для элементов 4 группы
Переходя к следующему периоду, ожидаем уменьшения I1 у натрия по сравнению с литием, поскольку, хотя заряд ядра и растет, но внешние электроны экранированы от ядра слоем электронов остова. Это общая закономерность - в группе первый потенциал ионизации уменьшается с ростом порядкового номера элемента. Однако можно обнаружить свойства, которые немонотонно меняются и в пределах группы. Это называется “вторичной периодичностью”. Вторичная периодичность связана с проникновением электронной плотности к ядру. (Ранее мы установили, что , например, s- электроны имеют n максимумов электронной плотности, и первый около ядра). Кстати, вторичная периодичность обычно и связана именно с s -электронами.
Рассмотрим сумму первых четырех потенцалов ионизации для элементов 4 группы åIi. Из рисунка 4.3 видно, что наблюдается немонотонность при переходе от Si к Ge (между внешними электронами и ядром появляется слой 3d-электронов) а также при переходе от Sn к Pb (5d, 4f).
Таким образом мы получили первый мощный инструмент для изучения свойств химических элементов и их соединений. Этим инструментом мы будем пользоваться впоследствии, при изучении неорганической химии.
Наблюдается периодичность изменения атомных радиусов, особенно у s- и p-элементов (в периоде атомные радиусы уменьшаются). У d- и f-элементов кривая изменения радиусов атомов по периоду имеет более плавный характер.
В одной и той же группе с увеличением номера периода атомные радиусы, как правило, возрастают в связи с увеличением числа электронных оболочек. Однако увеличение заряда ядра при этом оказывает противоположный эффект, поэтому увеличение атомных радиусов с увеличением номера периода относительно невелико, а в некоторых случаях, например у p-элементов III группы значение орбитального радиуса у Al (алюминия) больше, чем у Ga (галлия).
Вопросы для самоконтроля
1. Кто и когда открыл периодический закон?
2. В каком порядке расположил Д.И. Менделеев все известные элементы?
3. Какое изменение свойств элементов наблюдается при увеличении их атомной массы?
4. Как сформулировал Д.И. Менделеев периодический закон?
5. Что является графическим выражением периодического закона?
6. Сколько периодов и сколько групп в периодической системе?
7. Что такое период? Какие периоды являются малыми и какие большими?
8. Сколько элементов в каждом периоде?
9. Как изменяются свойства элементов в периодах слева направо?
10. Что такое группа? Из каких подгрупп состоит каждая группа периодической системы?
11. Как изменяются свойства элементов в главных подгруппах?
12. Чему равен положительный заряд ядра атома?
13. Чему равно число электронных слоев в атомах всех элементов данного периода?
14. Почему периодическая система элементов состоит из 7 периодов?
15. Какой электронный слой называется завершенным?
16. Чему равно число электронов на внешнем слое атомов элементов главных подгрупп?
17. Что такое главная подгруппа?
18. Как называются элементы, которые находятся в одной подгруппе?
19. Чем объясняется периодическое изменение свойств химических элементов и их соединений при увеличении порядкового номера?
20. Какие элементы называются s- элементами? Сколько s-элементов в каждом периоде?
21. Какие элементы называются p-элементами? Сколько p-элементов в каждом периоде (кроме первого и седьмого)?
22. Какие элементы называются d-элементами? Сколько d-элементов в каждом большом периоде?
23. Какие элементы называются f-элементами? В каких периодах находятся и где располагаются в периодическое системе f-элементы?
24. Какие электроны называются валентными электронами?
25. Что такое возбужденное состояние атома?
26. Что является причиной переменной валентности многих элементов?
27. Чем объясняется существование элементов с постоянной валентностью?
28. Чему равно максимальное число неспаренных электронов в возбужденных состояниях атомов для большинства элементов?
29. Напишите полные электронные конфигурации атомов элементов с порядковым номером 17 и 25. Назовите формирующие электроны этих элементов.
30. Напишите электронные конфигурации атомов хлора и марганца и ионов Cl- и Мn2+.
31. Напишите электронную конфигурацию атомов фосфора и ванадия. Являются ли они аналогами?
32. Напишите электронную конфигурацию бериллия и укажите элементы-аналоги. Как изменяются свойства аналогов с увеличением номера периода?
33. Приведите электронную конфигурацию калия. Покажите, как изменяются свойства элементов периода, в котором находится калий.
34. Напишите электронные конфигурации атомов Fe и F, а также ионов Fe2+, Fе3+ и F–.
Дата добавления: 2015-08-08; просмотров: 1546;
