Определение степени окисления элементов в соединениях
Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например:
N2H4 (гидразин)
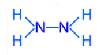
степень окисления азота – минус 2; валентность азота – 3.
Таблица 14.2 - Значения степеней окисления
| Любое простое вещество | |
| В сложных веществах (соединениях): Металлы первой группы главной подгруппы | +1 |
| Элементы второй группы главной подгруппы | +2 |
| Алюминий | +3 |
| Кислород | -2 (кроме пероксидов!!!) |
| Водород | +1 (в соединениях с металлами -1) |
| Фтор | -1 |
В тех случаях, когда степень окисления элемента может иметь разные значения в различных соединениях, её вычисляют исходя из требования: сумма положительных зарядов в молекуле должна быть равна сумме отрицательных зарядов в молекуле, т.е. молекула должна быть электронейтральной:
Na Cl ; H S O ;
(+1)+(-1)=0 2(+1)+ ? + 4(-2)=0
K N O ; K Cr O .
(+1) + ? + 3(-2)=0 2(+1) + ? + 7(-2)=0.
Дата добавления: 2015-08-08; просмотров: 994;
