Нарушения сердечного ритма и проводимости (с указанием формы). 18 страница
Согласно принципу, разработанному Фиком, количество введенного вещества, поступившего к месту регистрации с током крови, равно произведению объемной скорости кровотока (V) на разницу концентраций вещества в проксимальной и дистальной точках их определения (С1—С2):
I = V x (С1—С2),
где I—количество введенного вещества, V—объемная скорость кровотока; С1 и С2—концентрации вещества, дистальнее и проксимальнее места введения.
Отсюда, объемную скорость кровотока можно вычислить следующим образом:
V = I / (С1—С2).
При использовании классического метода Фика с вдыханием кислорода (см. рис. 6.51, б) величина (С1–С2) представляет собой артериовенозную разницу по кислороду, а при применении методов разведения (рис. 6.51, а), когда С2 равна нулю, значения С1 отражают среднюю концентрацию индикатора в месте регистрации.
Метод Фика. В классическом методе Фика в качестве вещества, вводимого в сосудистое русло, используется кислород, вдыхаемый легкими, потребление которого в 1 мин определяют с помощью спирометра. Для измерения артериовенозной разницы по кислороду (avРО2) используют порции крови, полученные из легочной артерии во время катетеризации правых отделов сердца, и из аорты или крупной артерии при ее пункции или катетеризации (рис. 6.51, б).
Согласно модифицированной формуле:
Vл = VО2/avРО2,
где Vл—легочный кровоток (мл/мин), VО2—поглощение О2 легкими (мл/мин); avРО2—артериовенозная разница по кислороду (мл или об.%).
При этом допускается, что легочный кровоток (Vл) равен количеству крови, выбрасываемому левым желудочком в минуту, т.е. минутному объему (МО).
Для определения газового состава кровь берут гепаринизированным шприцом одновременно из крупной артерии большого круга (или из аорты при ее катетеризации) и из легочной артерии. Содержание кислорода в этих пробах в объемных процентах (об.%) рассчитывают следующим образом:
РО2 (об.%) = Нb (г%) х 1,39 х N (%),
где РО2—содержание кислорода в пробе (об.%); Нb—концентрация гемоглобина (в г%), 1,39—константа Гюфнера (каждый грамм гемоглобина связывает 1,39 г кислорода); N—насыщение кислородом (%).
Для расчета артериовенозной разницы по кислороду можно использовать также значения напряжения кислорода в артериальной и венозной крови, измеряемые полярографически.
Получив значения артериовенозной разницы по кислороду и зная потребление О2 в 1 мин. (VО2), рассчитывают сердечный выброс (МО) по формуле:
МО = VО2/аРО2 - vРО2(л/мин),
где VО2—потребление О2 легкими (л/мин); аРО2 и vРО2—содержание кислорода в пробах артериальной и венозной крови соответственно.
Аналогичным способом можно измерить сердечный выброс, используя в качестве индикатора другие газы: СО2, ацетилен, закись азота и др.
Прямой метод Фика является классическим и наиболее точным методом определения сердечного выброса. Несмотря на необходимость проведения сложных и небезопасных для пациента манипуляций, в частности пункции или катетеризации артериального участка системы кровообращения, метод в последние годы достаточно широко применяется в кардиологической практике, преимущественно у больных с осложненным острым инфарктом миокарда.
 Запомните
Показаниями для применения метода Фика у больных острым инфарктом миокарда являются: Запомните
Показаниями для применения метода Фика у больных острым инфарктом миокарда являются:
|
Методы разведения индикаторов. Методы разведения индикаторов являются своеобразной модификацией метода Фика и основаны на быстром одномоментном введении непосредственно в кровеносное русло определенного количества какого-либо индикатора (красителя, радиоактивного вещества, охлажденной жидкости и т.п.) (см. рис. 6.51, а). Концентрацию индикатора определяют в пробах крови, взятых из участков, расположенных ниже по ходу кровотока (С1). Кровь извлекают из артерии (аорты) с постоянной скоростью с помощью автоматических насосов. Для определения концентрации индикатора чаще используют специальные проточные (кюветные) денситометры, через которые пропускают артериальную кровь. Денситометры снабжены источником света и фотоэлектрическим датчиком, измеряющим интенсивность светового потока, проходящего через исследуемую кровь
На рис. 6.52 приведена кривая изменения концентрации индикатора во времени, зарегистрированная ниже места его введения в артериальной системе. Через некоторое время (Т) после одномоментного (болюсом) введения индикатора в локтевую вену или правое предсердие его концентрация в месте забора крови начинает повышаться, достигает первого максимума (пика), а затем начинает экспоненциально падать. Нисходящая часть кривой первой (основной) волны обычно деформирована дополнительными волнами рециркуляции (повторного поступления индикатора из различных сосудистых областей). Для определения так называемой первичной кривой разведения, лишенной пиков рециркуляции, необходимо экстраполировать ее нисходящую часть, изобразив ее в логарифмическом масштабе. При этом нисходящая часть превращается в прямую линию. Продолжая ее до пересечения с осью абсцисс, получают первичную кривую, т.е. кривую, которая была бы записана в отсутствии рециркуляции (R.F. Schmitt, G.Thews). Время от начала кривой разведения до этой точки соответствует общему времени пассажа индикатора (Т).
Площадь под первичной кривой разведения (S) отражает суммарную концентрацию красителя, зарегистрированную в артерии (аорте) во время первого пассажа индикатора. Для определения этой площади необходимо знать калибровочный индекс (К), т.е. зависимость между концентрацией индикатора в мг/л и показаниями денситометра в миллиметрах на бумаге. Наиболее простым и распространенным способом определения цены деления записывающего устройства денситометра является способ Y.W. Nicholson, основанный на пропускании через денситометр нескольких проб крови обследуемого с известной концентрацией индикатора.
Зная калибровочный индекс, можно легко рассчитать площадь под первичной кривой разведения индикатора (S), например, суммируя все значения концентрации красителя, зарегистрированные через 1 с на протяжении первого пассажа индикатора.
Минутный объем плазмы, в которой растворен индикатор (МОпл.), вычисляют по формуле:
МОпл. = I х 60 / S x K (л/мин),
где I—количество введенного индикатора (в мг); S—площадь под кривой разведения (в мм/с); К —калибровочный индекс в мг/(л ґ мм).
Формула определения МО плазмы может иметь другой вид:
МОпл. = I х 60 / Ссрx Т (л/мин),
где I—количество введенного индикатора (в мг); Сср—средняя артериальная концентрация красителя (в мг/л),определяемая как усредненная величина всех моментных значений концентраций на протяжении времени первого пассажа; Т—время пассажа (в с).
| Рис. 6.52. Кривая разведения индикатора и измерения, необходимые для расчета сердечного выброса. Т — время пассажа индикатора; С к — концентрация индикатора (мг/л) во время калибровки; С ср. — средняя концентрация индикатора | 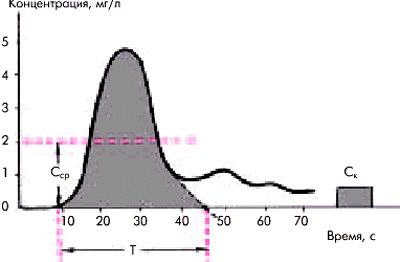
|
Чтобы теперь вычислить МО крови (МОкр.), необходимо сделать поправку на величину гематокрита (Нt):
МОкр. = МО плазмы х 100 / 100 - Ht,
где Ht — гематокрит (в %).
Например, если внутривенно введено 4 мг индикатора (I), средняя концентрация его в артериальной крови (Cср) составила 1,8 мг/л, время первого пассажа(Т) —40 с и Ht—40%, то МО плазмы будет равен:
МОпл. = 4 х 60 / 1,8 х 40 = 3,3 л/мин.
Делая поправку на гематокрит, получаем величину МО крови:
МОкр. = 3,3 х 100 / 60 = 5,49 л/мин.
Для определения сердечного выброса используют 2 группы индикаторов: 1) вещества, быстро покидающие сосудистое русло (например, индоциановый зеленый) и 2) вещества, длительно задерживающиеся в сосудистом русле (например, синий Эванса). Первые дают возможность выполнять частые повторные определения величины минутного объема крови; вторые—измерять, помимо МО, объем циркулирующей крови.
Метод термодилюции.При определении сердечного выброса в качестве индикатора может быть использован охлажденный изотонический раствор натрия хлорида или 5% раствор глюкозы. Стандартное количество охлажденной жидкости вводят в правое предсердие и с помощью термистора, расположенного в легочной артерии, регистрируют кривую снижения температуры крови (аналогичную кривой разведения красителя). В современных системах для этой цели используют многопросветные баллонные катетеры (рис. 6.53). Через один просвет катетера с отверстием на уровне правого предсердия вводят термоиндикатор; через другой—провод термистора, находящегося в легочной артерии.
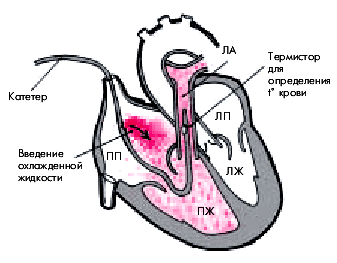
|
| Рис. 6.53. Принцип метода термодилюции для определения сердечного выброса |
Для вычисления МО определяют площадь под кривой разведения в градусах и разность температуры индикатора и крови. В общем виде формула расчета МО выглядит следующим образом:
МО = -V (t1-t2) х 60 х 1,08 / S,
где V—объем введенного индикатора; t1—температура крови; t2 — температура индикатора; 1,08 — коэффициент, учитывающий удельную плотность и теплоемкость крови и индикатора; S — площадь под кривой разведения.
Метод термодилюции отличается от других инвазивных методов определения сердечного выброса рядом преимуществ: отсутствует необходимость применения артериального катетера; существует возможность многократного повторного определения сердечного выброса (до 2–3 раз в мин.); на кривой разведения отсутствуют волны рециркуляции, что упрощает исследование; сердечный выброс (МО) определяется с высокой точностью.
Помимо величины МО крови — основного гемодинамического параметра — в клинике нередко рассчитывают и другие показатели, являющиеся, по сути, производными МО:
1. Ударный объем (УО):
УО = МО/ ЧСС (л).
2. Сердечный индекс (СИ), который представляет собой отношение МО крови к площади поверхности тела (S, м2). СИ вычисляют по формуле:
СИ = МО/ S (л/мин/м2).
При этом площадь поверхности тела (S) определяют по специальной номограмме или рассчитывают по формулам.
3. Ударный индекс (УИ) — отношение ударного объема к площади поверхности тела (S, м2). УИ вычисляют по формуле:
УИ = УО/ S ( л/м2).
4. Фракция выброса — отношение УО к величине КДО ЛЖ.
Левая вентрикулография. Селективная ангиокардиография левого желудочка (левая вентрикулография) имеет особое значение в диагностике органических и функциональных нарушений левого желудочка у больных ИМ. В этих случаях левая вентрикулография позволяет:
- обнаружить регионарные нарушения функции левого желудочка в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии;
- диагностировать аневризму левого желудочка и оценить ее локализацию и размеры;
- рассчитать важные и информативные показатели гемодинамики (КСО, КДО, УО, МО, СИ, УИ, ФВ, среднюю скорость кругового укорочения волокон).
Для расчета гемодинамических показателей проводят количественную обработку изображений полости левого желудочка, зарегистрированных в одной из проекций в конце систолы и диастолы (рис. 6.54). Вначале планиметрически определяют площадь полости левого желудочка (S) и длину его так называемой большой оси (L), соединяющей основание и верхушку. Расчетный диаметр по малой оси полости желудочка (D) определяются по формуле:
D = 4S / π х L,
после чего рассчитывают объем левого желудочка (V), используя геометрическую модель эллипсоида:
V = π х D2 х L / 6,
где V—объем левого желудочка; D—расчетный диаметр по малой оси; L—длина большой оси.
Зная конечно-диастолический (КДО) и конечно-систолический (КСО) объемы левого желудочка, легко можно рассчитать его ударный объем (УО):
УО = КДО —КСО.
| Рис. 6.54. Схематическое изображение левой вентрикулограммы и расчет ударного объема. Объяснение и обозначения в тексте | 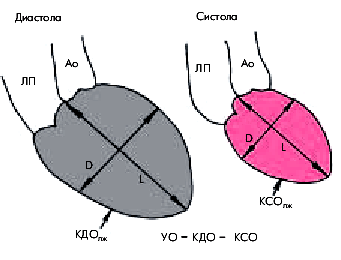
|
Фракцию выброса (ФВ), отражающую процент укорочения миокарда левого желудочка во время его сокращения, вычисляют следующим образом:
ФВ = УО / КДО х 100%,
где ФВ —фракция выброса; УО —ударный объем; КДО —конечно-диастолический объем желудочка.
Другой информативный показатель сократительной способности миокарда левого желудочка—среднюю скорость кругового укорочения волокон—вычисляют, рассчитывая величину диаметра по малой оси желудочка (D) в конце систолы и диастолы (т.н. конечно-систолический и конечно-диастолический размеры левого желудочка, или соответственно, КСР и КДР), а также общую продолжительность изгнания крови (Т):
Vср = КДР - КСР / КДР х Т,
где КДР и КСР—конечно-диастолический и конечно-систолический размеры (диаметры) левого желудочка; Т—время изгнания.
 Запомните
В норме ударный объем (УО) составляет 70–110 мл, фракция выброса (ФВ) — 0,55–0,65, а средняя скорость кругового укорочения волокон — не менее 1,2 с–1. Значение КДО левого желудочка более 90–100 мл указывает на наличие дилатации левого желудочка, вызванной его объемной перегрузкой или нарушением сократимости миокарда (подробнее — см. выше). Запомните
В норме ударный объем (УО) составляет 70–110 мл, фракция выброса (ФВ) — 0,55–0,65, а средняя скорость кругового укорочения волокон — не менее 1,2 с–1. Значение КДО левого желудочка более 90–100 мл указывает на наличие дилатации левого желудочка, вызванной его объемной перегрузкой или нарушением сократимости миокарда (подробнее — см. выше).
|
Напомним, что некоторые параметры гемодинамики могут быть определены также с помощью эхокардиографии. В этих случаях целесообразно использовать метод дисков (по Simpson), метод “площадь–длина” или допплер-эхокардиографическое определение параметров гемодинамики (см. главу 2).
Интерпретация результатов гемодинамического мониторинга. Для характеристики нарушений кровообращения при ИМ можно использовать 4 гемодинамических показателя: ДЗЛА, ЦВД, СИ и АД.
Давление заклинивания легочной артерии (ДЗЛА). Выше было показано, что основным гемодинамическим параметром, определяющим возникновение застоя крови в малом круге кровообращения, является давление заклинивания легочной артерии (ДЗЛА), которое в большинстве случаев соответствует давлению наполнения ЛЖ. Чем выше ДЗЛА, тем больше выражен застой крови в легких.
Таблица 6.11
Типы гемодинамики у больных острым ИМ (по В.Г. Попову с соавт., 1989 г., в модификации)
| Тип гемодинамики | СИ, л/мин/м2 | ДЗЛА, мм рт. ст. | ЦВД, мм рт. ст. | АД, мм рт. ст. | Примечания |
| Эукинетический (нормокинетический) | Норма (2,7–3,0) | Норма (8–12) | Норма (4–5) | Норма или γλ | Нет признаков острой левожелудочковой недостаточности или КШ |
| Гиперкинетический | λ > 3,0 | Норма или γ | Норма | Норма или | |
| Застойный | Норма | λ >= 18 | Норма или | Норма или γ | Отек легких |
| Гипокинетический | γγ <= 2,0 | λ >=20 | λλ | γγ | Отек легких или КШ |
| Гиповолемический | γγ <= 2,0 | γ <= 9,0 | γ | γγ | КШ (гиповолемический вариант) или терминальная стадия любого варианта КШ |
Центральное венозное давление (ЦВД), или давление в ПП, зависит в основном от 2-х факторов: 1) величины венозного притока крови к правому сердцу; 2) уровня диастолического давления в ПЖ. Диастолическое давление в ПЖ может увеличиваться при легочной артериальной гипертензии любого происхождения, в том числе развивающейся в результате острой левожелудочковой недостаточности, а также при поражении самого ПЖ.
Таким образом, повышение ЦВД (давления в ПП) у больных ИМ может наблюдаться как при застое крови в легких, вызванном острой левожелудочковой недостаточностью, так и при инфаркте самого ПЖ. Следует помнить и о других возможных причинах легочной гипертензии и повышения ЦВД (первичная легочная гипертензия, легочное сердце, ТЭЛА и др.).
Уменьшение ЦВД, как правило, связано с ограничением венозного притока крови к сердцу и часто наблюдается при коллапсе, шоке любого происхождения, приеме нитратов и других состояниях, сопровождающихся гиповолемией.
Сердечный индекс (СИ) — это третий гемодинамический показатель, используемый для характеристики нарушений кровообращения при ИМ. Он характеризует насосную функцию сердца. Величина СИ является главным показателем тяжести состояния больных ИМ: при снижении СИ с 2,7 л/мин/м2 (при неосложненном течении инфаркта) до 1,6 л/мин/м2 (при отеке легких и кардиогенном шоке) госпитальная летальность увеличивается с 2,2% до 55,5% (J. Forreste с соавт. 1976).
В табл. 6.11 представлены 5 типов изменений гемодинамики при ИМ. Три из них наиболее характерны для острой левожелудочковой недостаточности и кардиогенного шока: застойный, гипокинетический, гиповолемический. Застойный тип гемодинамики характеризуется повышением ДЗЛА больше 18 мм рт. ст. и ЦВД при почти нормальных значениях СИ. Нередко застойный тип гемодинамики предшествует появлению клинических признаков острой левожелудочковой недостаточности (сердечной астмы и альвеолярного отека легких). Этот тип гемодинамических нарушений свидетельствует о наличии венозного застоя в легких, что обычно подтверждается при проведении рентгенографии органов грудной клетки (см. выше). Отсутствие в этих случаях существенного уменьшения СИ обеспечивается в основном компенсаторным механизмом Старлинга: увеличением силы сокращения неповрежденных кардиомиоцитов в результате их умеренного растяжения за счет дилатации ЛЖ. Обнаружение застойного типа гемодинамики при ИМ является показанием для терапии диуретиками и венозными вазодилататорами (В.А. Люсов, 2000).
Гипокинетический тип гемодинамики при ИМ характеризуется не только повышением ДЗЛА (выше 20–22 мм рт. ст.) и ЦВД, но и снижением СИ (меньше 2,0 л/мин/м2). Такой тип гемодинамики свидетельствует о критическом падении насосной функции ЛЖ и усугублении венозного застоя в легких и характерен для клинической картины отека легких и/или начальных стадий кардиогенного шока и требует применения препаратов инотропного действия.
Гиповолемический тип обусловлен значительным нарушением венозного возврата крови к сердцу, что сопровождается резким снижением ЦВД (меньше 5 мм рт. ст.), ДЗЛА и диастолического давления в легочной артерии (меньше 9 мм рт. ст.) и СИ (ниже 1,8–2,0 л/мин/м2), а также систолического АД (меньше 90 мм рт. ст.) и пульсового давления (меньше 30 мм рт. ст.). Гиповолемический шок (тип) может быть обусловлен повторной рвотой, выраженной потливостью, лихорадкой, избыточным приемом мочегонных средств и усугубляется при введении растворов натрия нитропруссида и применении наркотических анальгетиков или β-адреноблокаторов.
Как вы помните, у части больных ИМ в острейшем периоде заболевания величина сердечного выброса до поры до времени сохраняется на должном уровне благодаря действию нескольких компенсаторных механизмов, в том числе умеренному повышению давления наполнения ЛЖ до 15–18 мм рт. ст. (норма 5–12 мм рт. ст.). Это обеспечивает достаточное диастолическое наполнение ЛЖ, стенка которого благодаря выраженному и распространенному ишемическому повреждению становится упругой и малорастяжимой (“жесткой”). При этом может наблюдаться умеренная дилатация ЛЖ (увеличение КДО ЛЖ), которая, согласно механизму Старлинга, сопровождается небольшим, но жизненно важным увеличением силы сокращения кардиомиоцитов и поддержанием сердечного выброса на относительно нормальных значениях СИ.
Ограничение венозного притока крови к сердцу и снижение величины ДЗЛА приводят к значительному уменьшению заполнения ЛЖ кровью во время диастолы и, соответственно, падению сердечного выброса.
 Запомните
Наиболее характерными гемодинамическими признаками гиповолемии являются: 1. Низкие значения ЦВД (меньше 5 мм рт. ст.) и, соответственно, спавшиеся периферические вены при осмотре. 2. Снижение ДЗЛА или диастолического давления в легочной артерии и отсутствие влажных хрипов и других признаков застоя крови в легких. 3. Снижение СИ, систолического и пульсового АД. 4. Отсутствие дилатации ЛЖ и протодиастолического ритма галопа при аускультации сердца Запомните
Наиболее характерными гемодинамическими признаками гиповолемии являются: 1. Низкие значения ЦВД (меньше 5 мм рт. ст.) и, соответственно, спавшиеся периферические вены при осмотре. 2. Снижение ДЗЛА или диастолического давления в легочной артерии и отсутствие влажных хрипов и других признаков застоя крови в легких. 3. Снижение СИ, систолического и пульсового АД. 4. Отсутствие дилатации ЛЖ и протодиастолического ритма галопа при аускультации сердца
|
Лечение острой левожелудочковой недостаточности и кардиогенного шока
Лечение больных ИМ, осложненным острой левожелудочковой недостаточностью, должно проводиться под постоянным контролем клинических, лабораторных, электрокардиографических данных, а также показателей гемодинамики. Интенсивная терапия этих больных требует проведения максимально полного гемодинамического мониторинга с определением ДЗЛА (или диастолического давления в легочной артерии), ЦВД, СИ, АД и ФВ. С этой целью может быть использована катетеризация правых отделов сердца катетером Свана–Ганца. При стойкой артериальной гипотензии (кардиогенный шок) показана установка артериального катетера. При отсутствии такой возможности приходится ориентироваться на:
· клинические данные — тяжесть состояния больного, ЧДД, ЧСС, аускультативные признаки застоя крови в легких и проявления периферической гипоперфузии;
· величину системного АД;
· значения ЦВД;
· результаты динамического эхокардиографического исследования;
· значения почасового диуреза
Лечение отека легких
Лечение больных отеком легких должно быть направлено на коррекцию ДЗЛА (диастолического давления в легочной артерии), признаков застоя крови в малом круге кровообращения и нормализацию сердечного индекса. Выбор тактики лечения в каждом конкретном случае зависит, прежде всего, от гемодинамического типа острой левожелудочковой недостаточности
Застойный тип гемодинамики. Если у больного с острой левожелудочковой недостаточностью систолическое АД нормально или умеренно снижено (выше 100–110 мм рт. ст.), диастолическое давление в легочной артерии (или ДЗЛА) составляет 18–20 мм рт. ст. (норма 8–12 мм рт. ст.), наблюдается удушье и влажные хрипы в легких, а СИ и ЦВД практически не изменены и отсутствуют признаки периферической гипоперфузии, показано применение следующих лечебных мероприятий.
Диуретики. Обычно используют петлевые диуретики. Фуросемид (лазикс) вводят внутривенно в дозе 20–80 мг однократно или несколько раз в день. При необходимости разовые дозы введения препарата могут быть увеличены (максимальная суточная доза — 2000 мг). Фуросемид, обладающий мощным диуретическим действием, уменьшает ОЦК, АД, величину постнагрузки и преднагрузки, а также ДЗЛА, что сопровождается уменьшением или исчезновением одышки и влажных хрипов в легких. Характерно, что гемодинамическая разгрузка малого круга кровообращения начинается уже через несколько минут после введения препарата, т.е. задолго до начала его диуретического действия (около 30 мин).
Внутривенное введение фуросемида целесообразно продолжать еще в течение 2–3 дней, а затем при необходимости перейти на пероральный прием препарата по 40–80 мг в сутки (однократно).
При лечении фуросемидом возможно нежелательное снижение систолического АД ниже 90 мм рт. ст. и уменьшение СИ, что сопровождается уменьшением коронарной перфузии и расширением зоны некроза, а также развитием гипокалиемии (угроза появления аритмий). Поэтому лечение требует постоянного гемодинамического контроля за эффектами препарата.
Вазодилататоры(нитроглицерин, натрия нитропруссид и др.) являются основными лекарственными средствами, которые используют для лечения отека легких у больных ИМ (при условии систолического АД не ниже 90 мм рт. ст.). Нитроглицерин обладает выраженными венодилатирующими свойствами, что позволяет значительно и быстро уменьшить приток крови к сердцу, величину преднагрузки и, соответственно, давление наполнения ЛЖ и признаки застоя в малом круге кровообращения. Кроме того, нитроглицерин, снижая тонус артериолярных сосудов (в том числе коронарных), способствует уменьшению ОПСС, величины постнагрузки на ЛЖ и увеличению коронарной перфузии. Натрия нитропруссид в большей степени, чем нитроглицерин, оказывает влияние на артериолы. Поэтому у больных ИМ, осложненном отеком легких с сопутствующей АГ, более целесообразно назначение натрия нитропруссида.
Нитроглицерин (1% спиртовой раствор) вводят внутривенно капельно на 0,9% растворе натрия хлорида, начиная с 5–10 мг в мин с постепенным увеличением скорости каждые 10 мин. Инфузию нитроглицерина прекращают:
- при достижении желаемого гемодинамического эффекта — уменьшении диастолического давления в легочной артерии (или ДЗЛА) до 15–17 мм рт. ст. или
- при снижении систолического АД на 10–15% (но не ниже 90 мм рт. ст.) или
- при появления побочных эффектов
В дальнейшем в течение 24–72 ч проводят “поддерживающие” инфузии раствора нитроглицерина, обеспечивающие оптимальный уровень давления заклинивая (ДЗЛА), и затем переходят к пероральному приему нитратов в обычных дозах (изосорбида динитрат или изосорбида мононитрат).
У больных с АГ и отеком легких предпочтительны внутривенные инфузии натрия нитропруссида, что обеспечивает не только снижение ДЗЛА, но и системного АД.
Морфин подавляет избыточную активность дыхательного центра, устраняя тем самым тахипноэ. Кроме того, морфин обладает периферическим вазодилатирующим действием, способствующим уменьшению венозного возврата крови к сердцу, снижению ДЗЛА и величины преднагрузки. Морфин вводят внутривенно струйно в дозе 2–5 мг.
Оксигенотерапия показана практически во всех случаях отека легких. Использование ингаляций увлажняющего кислорода через носовые катетеры или подача 100% кислорода с помощью маски со скоростью 6–12 л/мин позволяет не только уменьшить признаки гипоксии ЦНС и метаболического ацидоза, но и улучшить механические свойства самих легких, поскольку они страдают от гипоксии не меньше, чем другие органы. Повышение концентрации кислорода приводит к снижению афферентной импульсации с синокаротидных и других хеморецепторов и уменьшению тахипноэ.
При альвеолярном отеке легких необходимо использование пеногасителей, в частности, паров спирта.
Наличие выраженных клинических признаков отека легких, соответствующих III классу по классификации Т. Killip и J. Kimball, и быстрое прогрессирование дыхательной недостаточности, сопровождающееся спутанным сознанием, выраженным цианозом или землистым цветом кожи, изменением величины зрачков, активным участием в дыхании вспомогательной мускулатуры на фоне выраженной одышки, являются прямым показанием для интубации трахеи и проведения аппаратной искусственной вентиляции легких (ИВЛ) с положительным давлением в конце выдоха.
Более высокое внутриальвеолярное и внутрибронхиальное давление, создаваемое ИВЛ, способствует увеличению растяжимости легких, расправлению ателектазов и улучшению вентиляционно-перфузионных соотношений и газообмена. Кроме того, повышенное внутригрудное давление нарушает венозный возврат крови к сердцу и способствует снижению ДЗЛА и разгрузке малого круга кровообращения. Методика ИВЛ более подробно описана в последующих главах руководства.
Гипокинетический тип гемодинамики. Если у больного с клинической картиной отека легких имеет место не только значительное повышение ДЗЛА (выше 20 мм рт. ст.) и ЦВД, но и снижение СИ (меньше 2,0 л/мин/м2) и систолического АД, речь идет о выраженном нарушении насосной функции ЛЖ, которое нередко сочетается с признаками периферической гипоперфузии (олигурия, похолодание конечностей, артериальная гипотония), т.е. с начальными проявлениями кардиогенного шока. В этих случаях активное воздействие на ДЗЛА и застой крови в легких с использованием вазодилататоров должно сочетаться с обязательным применением препаратов, обладающих инотропным действием.
Дата добавления: 2015-08-04; просмотров: 870;
