Нарушения сердечного ритма и проводимости (с указанием формы). 15 страница
|
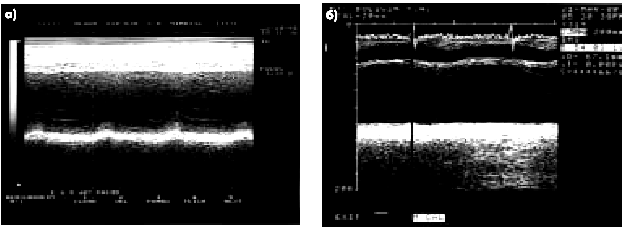
| Рис. 6.37. Две одномерные эхокардиограммы, зарегистрированные у больных с постинфарктным кардиосклерозом: а — акинезия межжелудочковой перегородки; б — акинезия заднедиафрагмального (нижнего) сегмента ЛЖ |
Систолическая функцияЛЖ. Эхокардиографическая оценка систолической функции ЛЖ проводится с использованием нескольких методов. Наиболее приемлемыми из них считаются метод дисков (по Simpson), метод “площадь–длина”, а также метод допплер-ЭхоКГ, подробно описанные в главе 2.
Следует помнить, что снижение ФВ до 40% и менее расценивается как один из важных критериев неблагоприятного прогноза ИМ.
Диастолическая функция ЛЖ. Нарушения диастолической функции ЛЖ выявляются практически у всех больных ИМ с зубцом Q и у части пациентов с нетрансмуральным ИМ. В основе диастолической дисфункции ЛЖ при ИМ лежит увеличение ригидности (снижение растяжимости) ишемизированного и некротизированного миокарда желудочка. Оценку диастолической функции ЛЖ проводят с использованием допплерэхокардиографии по методике, описанной ранее (см. главу 2). Изучают отдельные показатели трансмитрального диастолического потока крови. При ИМ часто наблюдаются признаки диастолической дисфункции I типа (тип замедленной релаксации ЛЖ), которая характеризуется снижением скорости изоволюмического расслабления и объема раннего диастолического наполнения (Рeak Е). При этом увеличиваются скорость и объем кровотока во время систолы предсердия (Рeak А). На допплер-кардиограммах трансмитрального кровотока определяются снижение амплитуды пика Е и увеличение высоты пика А (рис. 6.38). Это свидетельствует о том, что бульшая часть диастолического кровотока вследствие нарушения податливости стенки ЛЖ осуществляется во время активной систолы ЛП. Допплер-эхокардиографические признаки диастолической дисфункции ЛЖ при остром ИМ ассоциируются с более высоким риском возникновения застоя крови в малом круге кровообращения.
Мониторирование параметров гемодинамики.Регистрация допплер-эхокардиограмм систолического потока крови в выносящем тракте левого и правого желудочков позволяет неинвазивно определять некоторые важные параметры гемодинамики — величину сердечного выброса, ФВ и уровень давления в легочной артерии (см. главу 2).
Использование метода эхокардиографии для диагностики аневризмы ЛЖ, перикардита, острой недостаточности митрального клапана и других осложнений описано в разделе “Осложнения ИМ” и последующих главах руководства.
| Рис. 6.38. Допплер-эхокардиограмма больного с признаками диастолической дисфункции ЛЖ | 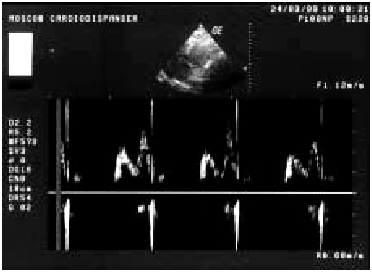
| ||
| 6.4.8. Сцинтиграфия миокарда с 99mТс-пирофосфатом (технецием) | |||

| |||
Сцинтиграфия миокарда с 99mТс-пирофосфатом (технецием)применяется для визуализации очагов инфаркта миокарда, поскольку это радиоактивное вещество избирательно накапливается в некротизированной ткани сердечной мышцы в том случае, если в зоне поражения сохраняется по крайней мере 10–40% кровотока (в том числе коллатерального), необходимого для доставки технеция к очагу некроза.
Сцинтиграммы регистрируют в трех cтандартных проекциях через 90 мин после внутривенного введения индикатора. Это время необходимо для очищения крови от индикатора за счет поглощения его костной и некротизированной тканью. Анализ сцинтиграмм проводят после процедуры накопления импульсов излучения и процедуры вычитания фона.
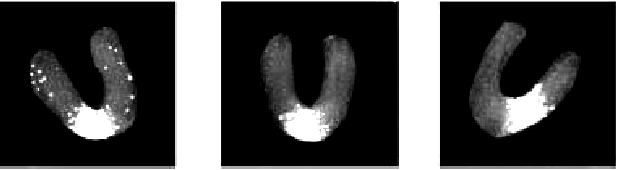
Очаг острого инфаркта миокарда выявляется с помощью этой методики уже через 24 ч от начала заболевания (рис. 6.39). При обычном течении инфаркта очаг некроза визуализируется вплоть до 8–10 дня болезни. Если же технеций продолжает накапливаться в сердечной мышце на 2–3-й неделе от начала заболевания, это свидетельствует о замедлении репаративных процессов, затяжном течении инфаркта или развитии постинфарктной аневризмы.
Для диагностики нарушений перфузии миокарда у больных ИМ, осложненным блокадой ножек пучка Гиса, может использоваться также методика сцинтиграфии миокарда с 201Тl, описанная в главе 5.
|
| Рис. 6.39. Сцинтиграммы миокарда с 99m Тс-пирофосфатом, зарегистрированные у больного с заднедиафрагмальным (нижним) инфарктом миокарда с зубцом Q. Заметно накопление технеция в заднедиафрагмальном (нижнем) сегменте ЛЖ (светлые участки сцинтиграмм) |
 Запомните
Применение методики сцинтиграфии миокарда с технецием показано для верификации инфаркта миокарда преимущественно в тех случаях, когда имеются существенные затруднения в интерпретации изменений ЭКГ, в связи с наличием блокады ножек пучка Гиса, пароксизмальных нарушений сердечного ритма или признаков перенесенного в прошлом инфаркта миокарда. Запомните
Применение методики сцинтиграфии миокарда с технецием показано для верификации инфаркта миокарда преимущественно в тех случаях, когда имеются существенные затруднения в интерпретации изменений ЭКГ, в связи с наличием блокады ножек пучка Гиса, пароксизмальных нарушений сердечного ритма или признаков перенесенного в прошлом инфаркта миокарда.
| ||
| 6.4.9. Рентгенография органов грудной клетки | ||

| ||
У больных ИМ с зубцом Q, госпитализированных в кардиореанимационное отделение, рентгенография органов грудной клетки, как правило, осуществляется по специальным показаниям, а именно: с целью своевременной диагностики интерстициального отека легких и некоторых других осложнений заболевания (пневмонии, инфаркта легкого, гидроторакса или выпота в полость перикарда), рентгенологические признаки которых описаны в соответствующих главах руководства. Исследование проводится с помощью специальных портативных рентгеновских аппаратов непосредственно в кардиореанимационном отделении в положении больного лежа на спине.
| 6.4.10. Коронароангиография |

|
Селективную коронароангиографию (КАГ) у больных острым ИМ осуществляют в тех случаях, когда предполагается оперативное вмешательство на коронарных сосудах — чрескожная транслюминальная ангиопластика или аорто-коронарное шунтирование. Полученные при КАГ данные очень важны при выборе метода хирургической коррекции обструктивных поражений КА. Поскольку при выполнении КАГ, как правило, производят левую вентрикулографию, это позволяет оценить также ряд важных гемодинамических параметров и верифицировать некоторые тяжелые осложнения ИМ (аневризму ЛЖ, разрыв МЖП и др.) (см. ниже).
Наиболее общимипоказаниями к экстренной КАГ с последующей хирургической коррекцией у больных острым ИМ являются:
- кардиогенный шок;
- тяжелая левожелудочковая недостаточность, особенно если она сочетается с острой митральной недостаточностью или разрывом межжелудочковой перегородки;
- повторные эпизоды угрожающих жизни желудочковых аритмий (желудочковая тахикардия, фибрилляция желудочков);
- ранняя постинфарктная стенокардия.
Следует отметить, что в последние годы в крупных кардиологических центрах существенно расширены показания для проведения экстренной КАГ. Исследование осуществляется теперь многим больным острым ИМ, госпитализированным в ранние сроки от начала заболевания (4–6 ч), с целью восстановления коронарного кровотока или ограничения зоны некроза с помощью селективного интракоронарного введения тромболитиков или хирургической коррекции кровообращения в КА.
Методика проведения КАГ и интерпретация результатов исследования подробно описаны в главе 5.
| 6.4.11. Лечение неосложненного инфаркта миокарда с зубцом Q |

|
Сложившаяся в настоящее время система лечения больных ИМ включает:
- специализированные кардиологические бригады скорой помощи (догоспитальный этап), оказывающие первую врачебную помощь больным ИМ;
- специализированные инфарктные отделения с блоком интенсивной терапии или отделением кардиореанимации (госпитальный этап);
- специализированные реабилитационные центры (отделения больниц и кардиологические санатории);
- кардиологические консультативно-диагностические центры и кардиологические кабинеты поликлиник (диспансеризация больных, перенесших ИМ).
Основными стратегическими целями лечения больных на догоспитальном и госпитальном этапах являются:
1. Ранняя реперфузия миокарда или коронарная реваскуляризация, а также предотвращение дальнейшего тромбообразования.
2. Ограничение очага некроза и периинфарктной ишемической зоны с помощью гемодинамической и метаболической разгрузки сердца.
3. Предупреждение или скорейшее устранение осложнений ИМ.
4. Физическая и психологическая реабилитация больных ИМ.
Все больные с подозрением на наличие формирующегося ИМ с зубцом Q, т.е. пациенты с острым коронарным синдромом и стойким подъемом сегмента RS–Т, должны быть незамедлительно госпитализированы в блок интенсивной терапии специализированных кардиологических отделений. Базисная терапия, которая осуществляется у всех больных ИМ с зубцом Q, независимо от наличия или отсутствия тех или иных осложнений, включает следующие мероприятия:
- купирование боли (анальгезия);
- тромболитическая терапия (естественно, с учетом индивидуальных показаний и противопоказаний);
- антитромботическая и антиагрегантная терапия;
- оксигенотерапия;
- применение антиишемических ЛС;
- применение ингибиторов АПФ и антагонистов рецепторов к ангиотензину II.
Таким образом, основные принципы базисной терапии ИМ с зубцом Q (терапии неосложненного ИМ) во многом напоминают таковые у больных НС (см. раздел 6.3).
Купирование боли
Купирование ангинозного приступа является обязательным условием всех дальнейших лечебных мероприятий. Сохраняющася ангинозная боль поддерживает гиперактивацию САС, которая сопровождается тахикардией, положительным инотропным действием, увеличением потребности миокарда в кислороде и приводит, в конечном счете, к увеличению зоны инфаркта. Кроме того, на фоне активации САС понижается порог фибрилляции желудочков, что само по себе может иметь фатальные последствия (А.Л. Сыркин).
Если отсутствуют признаки резкого падения сердечного выброса и АД (удовлетворительное наполнение артериального пульса и приемлемые цифры АД), больному рекомендуют повторный прием нитроглицерина сублингвально или ингаляционное орошение слизистой полости рта аэрозолем нитроглицерина или изосорбида динитрата. Эти простые мероприятия должны быть проведены при первом контакте больного с врачом, еще до регистрации ЭКГ.
Морфин. Классическим средством купирования боли у больных ИМ является применение наркотических анальгетиков. Морфин, являющийся агонистом опиоидных рецепторов, помимо быстрого купирования боли, уменьшает венозный тонус и, следовательно, снижает венозный возврат крови к сердцу, величину преднагрузки и потребность миокарда в кислороде. Морфин обладает также выраженным седативным эффектом. Кроме того, он оказывает выраженное ваготоническое действие, вызывает синусовую брадикардию и артериальную гипотонию.
У больных с острым коронарным синдромом, в том числе с подозрением на развитие ИМ, морфин вводится внутривенно в первоначальной дозе 2–4 мг, а затем по 2–6 мг каждые 10–15 мин (суммарно не более 20–30 мг) вплоть до купирования боли или появления побочных эффектов:
- тошноты, рвоты, синусовой брадикардии (ваготонические эффекты);
- артериальной гипотензии;
- признаков угнетения дыхательного центра.
Следует помнить, что ваготонические побочные эффекты сравнительно легко устраняются внутривенным введением (0,5–1,0 мл) 0,1% раствора атропина сульфата, а признаки угнетения дыхательного центра — внутривенным введением 0,1–0,2 мг налоксона.
 Запомните
У больных острым коронарным синдромом, в том числе у пациентов с подозрением на ИМ, с целью купирования ангинозного приступа используется морфин. Препарат вводится только внутривенно, поскольку при подкожном введении анальгетический эффект наступает не раньше чем через 10–15 мин, что недопустимо при лечении больных острым ИМ. Запомните
У больных острым коронарным синдромом, в том числе у пациентов с подозрением на ИМ, с целью купирования ангинозного приступа используется морфин. Препарат вводится только внутривенно, поскольку при подкожном введении анальгетический эффект наступает не раньше чем через 10–15 мин, что недопустимо при лечении больных острым ИМ.
|
При отсутствии эффекта от применения морфина и сохранении болевого синдрома показано внутривенное капельное введение растворов нитроглицерина и/или b-адреноблокаторов, которые способствуют, как известно, гемодинамической разгрузке сердца и уменьшению потребности миокарда в кислороде (подробнее см. главы 2 и 5).
Нитроглицерин (0,1% раствор) вводят внутривенно капельно. Так же как и при НС, начальная скорость внутривенной инфузии раствора нитроглицерина составляет 10 мкг/мин. Затем она увеличивается на 10 мкг/мин каждые 3–5 мин до появления реакции АД или изменения симптоматики. При этом систолическое АД не должно быть ниже 110 мм рт. ст. или у больного с артериальной гипертензией — на 25% ниже исходного уровня.
β-адреноблокаторы. Внутривенное введение b-адреноблокаторов в острейшем периоде ИМ может способствовать купированию болевого синдрома и ограничению зоны некроза. b-адреноблокаторы уменьшают сократимость и потребность миокарда в кислороде, ослабляют влияние катехоламинов на сердце, снижают ЧСС, АД, повышают порог фибрилляции желудочков и предупреждают возникновение суправентрикулярных нарушений ритма (подробнее см. главы 2, 3 и 5). Рекомендуется использовать кардиоселективные b1-адреноблокаторы (метопролол, атенолол и др.).
Метопролол вводят внутривенно в дозе 5 мг с 5-минутным интервалом (до трех раз, если ЧСС сохраняется не ниже 55–60 уд. в мин и систолическое АД выше 100 мм рт. ст.). В последующем целесообразно перейти на пероральный прием метопролола в дозе 50 мг 2 раза в день в течение первых 48 ч, а затем по 100 мг 2 раза в сутки.
Атенолол вводят внутривенно медленно в дозе 5 мг в течение 5 мин. При необходимости через 10 мин возможно повторное внутривенное введение 5 мг атенолола, если отсутствует уменьшение ЧСС и АД. Еще через 10 мин атенолол назначают внутрь в дозе 50 мг. В последующем препарат принимают внутрь в дозе 50–100 мг 1–2 раза в сутки.
Следует учитывать противопоказания к применению b-адреноблокаторов у больных ИМ:
- наличие признаков застойной сердечной недостаточности (в том числе влажных хрипов в нижних отделах легких);
- ЧСС менее 60 уд. в мин;
- АВ-блокада II, III и I степени при Р–Q(R) более 0,24 с;
- систолическое АД меньше 90 мм рт. ст.;
- наличие сопутствующей бронхиальной астмы;
- хронический обструктивный бронхит при наличии сухих свистящих хрипов в легких (один из признаков бронхиальной обструкции).
Оксигенотерапия
Оксигенотерапия показана всем больным ИМ с зубцом Q. Применение кислорода через маску или интраназальный катетер позволяет увеличить насыщение артериальной крови кислородом (SаO2) выше 90%, что приводит к увеличению его диффузии в область ишемизированного миокарда из близлежащих интактных участков сердечной мышцы, способствуя уменьшению размеров зоны ишемического повреждения (периинфарктной зоны). Оксигенотерапия показана больным ИМ по меньшей мере на протяжении первых 1–2 суток после госпитализации в блок интенсивной терапии. В последующем кислород используется в основном у пациентов с осложненным течением ИМ (см. ниже), например при наличии признаков застойной сердечной недостаточности, при кардиогенном шоке, рецидивирующих приступах ангинозных болей и т.п.
Антитромбоцитарные средства
Обязательным условием ведения больных ИМ является назначение антитромбоцитарных ЛС. Чаще всего назначают аспирин вдозе не выше 325 мг в сутки. При первом же контакте с больным рекомендуют разжевать таблетку аспирина без оболочки (250–325 мг), если этого не было сделано раньше. При наличии противопоказаний к его применению возможно использование тиклопидина или клопидогреля, являющихся ингибиторами АДФ-рецепторов тромбоцитов. Эффективным является также сочетание приема аспирина и клопидогреля (подробнее см. главу 5 и раздел 6.3).
В нескольких клинических исследованиях продемонстрирована эффективность внутривенного введения блокаторов гликопротеиновых IIb/IIIа рецепторов тромбоцитов, особенно у тех пациентов, у которых по экстренным показаниям проводится тромболитическая терапия, коронарная ангиопластика или аорто-коронарное шунтирование.
Механизмы действия и способы применения антитромбоцитарных ЛС подробно описаны в разделе 6.3 и в главе 5.
Гепарины
Как было показано в разделе 6.3, гепарин является эффективным непрямым ингибитором тромбина, оказывающим свое антитромботическое действие благодаря активации физиологического антикоагулянта — антитромбина III. Назначение гепарина при остром коронарном синдроме с подъемом сегмента RS–Т, в том числе при ИМ с зубцом Q, оправдано прежде всего как средства, препятствующего дальнейшему тромбообразованию в КА и уменьшающего частоту венозного и внутрижелудочкового пристеночного тромбоза с последующим развитием тромбоэмболических осложнений.
Методика применения, побочные эффекты и противопоказания к лечению нефракционированным и низкомолекулярными гепаринами подробно изложены в разделе 6.3.
Антиишемические препараты
Антиишемические препараты широко применяют при лечении больных ИМ с зубцом Q. Благодаря эффективной гемодинамической разгрузке сердца, они способствуют ограничению размеров ИМ, в первую очередь, размеров периинфарктной зоны. Последняя представляет собой участки сохранившего свою жизнеспособность миокарда, которые непосредственно граничат с зоной некроза.
Наиболее целесообразно назначение больным ИМ двух групп ЛС, обладающих свойством ограничивать периинфарктную зону: b-адреноблокаторов и нитратов.
β-адреноблокаторы. При отсутствии противопоказаний β-адреноблокаторы рекомендуется назначать всем больным ИМ. Положительное действие этих препаратов при ИМ связано с их отрицательным инотропным и хронотропным действием, сопровождающимся снижением потребности миокарда в кислороде и урежением сердечных сокращений. Это до некоторой степени дает возможность поддерживать жизнеспособность миокарда периинфарктной зоны и, тем самым, ограничивать площадь инфаркта. Кроме того, β-адреноблокаторы обладают способностью повышать порог фибрилляции, что уменьшает риск возникновения фатальных нарушений сердечного ритма. Наконец, воздействие β-адреноблокаторов на активность САС и РААС сопровождается замедлением процесса ремоделирования ЛЖ и оказывает существенное влияние на выживаемость больных в ближайшем и отдаленном периодах ИМ.
Выбор того или иного β-адреноблокатора для лечения больных ИМ, а также оптимальных суточных доз этих ЛС основан на тех же принципах, которые используются при лечении больных НС (см. раздел 6.3).
Нитраты применяются у больных ИМ с целью гемодинамической разгрузки ЛЖ и уменьшения потребности миокарда в кислороде. Доказано положительное действие нитратов на величину периинфарктной зоны и уменьшение или купирование некоторых симптомов заболевания (болей в области сердца, одышки и других признаков левожелудочковой недостаточности).
После внутривенной инфузии раствора нитроглицерина (см. выше) показан переход на применение других лекарственных форм нитратов. Чаще используют таблетированные формы короткодействующих, а в дальнейшем и пролонгированных, нитратов, предусматривая ежедневно 8–10-часовой “безнитратный” период с целью уменьшения риска возникновения толерантности к этим препаратам (подробнее см. главу 5).
Метаболические препараты
В главе 5 было показано, что применение у больных ИБС препаратов, обладающих свойством оптимизировать энергетический обмен ишемизированной сердечной мышцы, оказывает существенное влияние на сохранение жизнеспособности миокарда, находящегося в условиях дефицита кислорода и основных энергетических субстратов. Это объясняет необходимость использования этих препаратов и у больных острым ИМ с целью коррекции нарушенных обменных процессов в кардиомиоцитах периинфарктной зоны. В настоящее время у больных ИМ используют, в основном, два способа активного воздействия на метаболизм сердечной мышцы: применение триметазидина (предуктала) и внутривенное капельное введение глюкозо-инсулино-калиевой смеси.
Триметазидин обладает прямым цитопротекторным эффектом, реализуемым на уровне кардиомиоцита и субклеточных структур. Напомним, что в условиях хронической ишемии миокарда происходит увеличение интенсивности b-окисления ЖК и, наоборот, уменьшается интенсивность окислительного фосфорилирования. В результате на конечном этапе гликолиза возрастает сдвиг в сторону образования лактата, что сопровождается метаболическим внутриклеточным ацидозом, накоплением в кардиомиоците ионов Nа+ и Са2+ и значительным снижением сократимости.
Ингибируя b-окисление ЖК, триметазидин способствует увеличению интенсивности окислительного фосфорилирования. В результате улучшается сопряжение анаэробного гликолиза и окислительного фосфорилирования, уменьшается образование лактата и накопления в клетке ионов Н+, Nа+ и Са2+ в клетке, что сопровождается отчетливым антиишемическим эффектом (подробнее см. главу 5).
Триметазидин назначают в обычной терапевтической дозе — 1 табл. 3 раза в день.
Глюкозо-инсулино-калиевая смесь (ГИК) широко используется для лечения больных ИМ на протяжении более 40 лет. Недавно были получены убедительные подтверждения того, что ГИК действительно оказывает положительный эффект у больных острым ИМ. Применение глюкозо-инсулино-калиевой смеси основано на представлениях о том, что увеличение доставки глюкозы к ишемизированному миокарду может оказывать защитное действие, стимулируя накопление гликогена в кардиомиоцитах. Последний служит источником глюкозы в ходе анаэробного гликолиза и тем самым повышает образование АТФ (G.D. Lopaschuk, 2000). Не исключено, что введение глюкозо-инсулино-калиевой смеси способствует уменьшению уровня циркулирующих в крови жирных кислот, поскольку инсулин ингибирует мобилизацию свободных жирных кислот из адипоцитов.
Результаты, полученные в исследовании ЕСLА, свидетельствуют о значительном уменьшении риска летального исхода у больных острым ИМ, которые получали в качестве одного из компонентов комплексной терапии глюкозо-инсулино-калиевую смесь.
Ингибиторы АПФ
В последнее время ингибиторы АПФ все шире используют для лечения больных острым ИМ и пациентов с постинфарктным кардиосклерозом, в первую очередь, с целью профилактики прогрессирования дисфункции ЛЖ.
Помимо оптимизации уровня АД, величины постнагрузки и преднагрузки, уменьшения продукции альдостерона и, соответственно, задержки натрия и воды в организме, ингибиторы АПФ способны ограничивать неблагоприятные последствия быстрого ремоделирования сердца у больных ИМ. Так, ингибиторы АПФ уменьшают влияние тканевого ангиотензина II на процессы гипертрофии кардиомиоцитов, интерстициального фиброза, улучшают функцию эндотелия, повышая продукцию вазодилатирующих субстанций и способствуя увеличению коронарного резерва. Кроме того, ингибиторы АПФ способствуют стабилизации атеросклеротической бляшки и уменьшению частоты возникновения повторного острого коронарного синдрома.
По данным нескольких кооперативных исследований, применение ингибиторов АПФ у больных, перенесших ИМ, приводит к достоверному уменьшению (на 11–27%) числа повторных ИМ и эпизодов нестабильной стенокардии, частоты развития сердечной недостаточности и общей летальности больных. Показано, что наилучшие результаты лечения ингибиторами АПФ наблюдаются у больных “высокого риска”, а именно:
- при наличии клинических признаков сердечной недостаточности;
- при значительной дилатации ЛЖ;
- при ФВ ЛЖ меньше 40% (независимо от наличия или отсутствия клинических признаков СН);
- при переднем ИМ;
- при обширном ИМ любой локализации, если зона акинезии (по данным ЭхоКГ) превышает 20%.
Именно у этих больных наиболее показано раннее назначение ингибиторов АПФ — на 3-й день от начала инфаркта. Методика лечения ингибиторами АПФ, побочные эффекты и противопоказания подробно описаны в главе 2 настоящего руководства.
Тромболитическая терапия
Тромболитическая терапия расценивается в настоящее время в качестве основного метода восстановления коронарного кровотока (реперфузии) у больных острым коронарным синдромом со стойким подъемом сегмента RS–Т. Многочисленные широкомасштабные рандомизированные исследования продемонстрировали существенное (в среднем, на 20%) снижение летальности больных ИМ. Причем тромболизис оказался наиболее эффективным в ранние сроки ИМ, особенно в течение первого часа с момента возникновения ангинозного приступа (исследование GISSI). Раннее внутривенное введение различных фибринолитических препаратов, обладающих способностью растворять фибриновый тромб, позволяет эффективно восстанавливать коронарный кровоток у большинства больных ИМ. Наилучшие результаты получают у больных с первичным ИМ передней локализации, тогда как при повторном ИМ или его задней локализации снижение летальности в результате внутривенного тромболизиса менее заметно (GISSI).
Важно еще раз подчеркнуть, что у больных с клинической картиной острого коронарного синдрома без стойкого подъема сегмента RS–Т (например, при депрессии сегмента или/и инверсии зубцов Т) на фоне тромболизиса выявляется тенденция к повышению смертности. Поэтому таким больным тромболизис в настоящее время не проводят.
Механизмы положительного эффекта
В организме взрослого человека, особенно больного атеросклерозом и ИБС, постоянно происходит внутрисосудистая агрегация тромбоцитов и “запускается” процесс тромбообразования. Однако этот процесс находится под контролем сложной фибринолитической системы, а также системы физиологических антикоагулянтов (антитромбина III, гепарина, a2-макроглобулина, a-антитрипсина I и др.), что в большинстве случаев либо прерывает этот процесс на его ранних стадиях, либо сопровождается спонтанным расплавлением образовавшихся тромбов. Это доказывается, например, результатами коронароангиографических исследований у больных трансмуральным ИМ с зубцом Q. Если КАГ проводят в течение первых 4-х часов от начала заболевания, окклюзия КА обнаруживается почти у 90% больных. При обследовании в период от 12 до 24 ч эта цифра снижается до 65% (М. DeWood с соавт, 1980). Эти данные, вероятно, свидетельствуют о том, что у значительной части больных ИМ происходит спонтанная реканализация тромба за счет естественного тромболизиса.
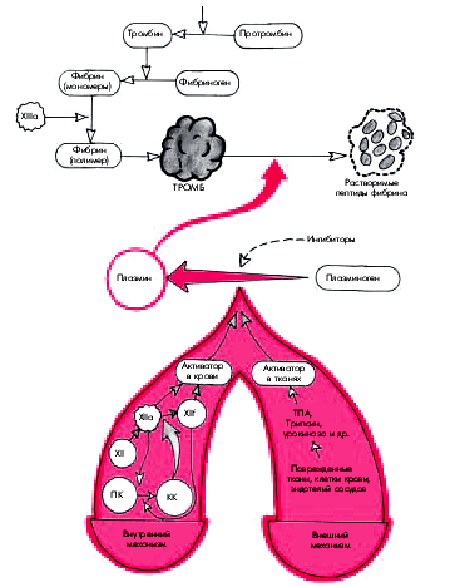
Напомним, что главным компонентом системы фибринолиза у человека (рис. 6.40) является фермент плазмин (фибринолизин), который путем гидролиза отщепляет от фибрина растворимые пептиды, способствуя тем самым растворению тромба. Плазмин расщепляет также некоторые факторы свертывания крови (фибриноген, факторы V, VII, IX, XI, XII). Кроме того, образующиеся в процессе тромболизиса растворимые пептиды фибрина тормозят действие тромбина. Таким образом, плазмин не только растворяет образовавшийся тромб, но и препятствует дальнейшему свертыванию крови.
|
| Рис. 6.40. Схема фибринолиза. ПК — прекалликреин; КК — калликреин; ТПА — тканевой активатор плазминогена |
Плазминнаходится в крови в виде неактивного плазминогена. Активация плазминогена обеспечивается многими механизмами, в том числе некоторыми факторами свертывания крови. Внутренний механизм активации фибринолиза обеспечивается преимущественно активированным фактором Хагемана (ХIIа) и его фрагментом (XIIf) в комплексе с калликреином и высокомолекулярным кининогеном. Следует помнить, что активация калликреин-кининовой системы возникает не только при свертывании крови, но и при многочисленных воспалительных и дегенеративных повреждениях внутренних органов.
Внешний механизм активации фибринолиза осуществляется с помощью тканевых активаторов плазминогена, содержащихся в сосудистом эндотелии, эритроцитах, тромбоцитах, лейкоцитах, моче (урокиназа, образующаяся в юкстагломерулярном аппарате почек), желчи, слюне и т.п. Основным внешним активатором плазминогена является активатор тканевого типа (тканевой активатор плазминогена — ТАП), который синтезируется в сосудистом эндотелии при любом повреждении сосуда, его закупорке тромбом, при интенсивном сжатии (в том числе сжатии манжетой), а также под влиянием вазоактивных веществ и некоторых лекарственных препаратов (адреналина, норадреналина, никотиновой кислоты и др.). Наконец, внешними активаторами плазминогена могут служить также урокиназа, стрептокиназа и другие аналогичные вещества, вводимые парентерально при лечении больных с тромбозами и тромбоэмболиями. Активация фибринолитической системы в подавляющем большинстве случаев вторична и возникает как следствие тромбозов, тромбоэмболий или ДВС-синдрома.
Дата добавления: 2015-08-04; просмотров: 685;
