Нарушения сердечного ритма и проводимости (с указанием формы). 9 страница
В основе возникновения острой ишемии миокарда у этих больных лежит формирование неокклюзирующего пристеночного, преимущественно тромбоцитарного (“белого”) тромба, причем, как правило, в области расположения осложненной атеросклеротической бляшки (см. рис. 6.4). В результате возникает преимущественно субэндокардиальная (нетрансмуральная) ишемия сердечной мышцы.
В последующем у большинства больных острым коронарным синдромом без стойкого подъема сегмента RS–T возможно возникновение либо нестабильной стенокардии, либо острого ИМ без зубца Q. Эти две формы ИБС (НС и ИМ без зубца Q) различаются между собой по отсутствию или наличию маркеров некроза (повышенных уровней тропонинов, МВ КФК и КФК).
Установлено, что у больных острым коронарным синдромом без стойкого подъема сегмента RS–T применение тромболитической терапии малоэффективно. Лечение таких больных должно быть направлено на устранение выраженной ишемии миокарда и предотвращение процесса дальнейшего тромбообразования.
| Рис. 6.4. Механизм возникновения острого коронарного синдрома без стойкого подъема сегмента RS–Т | 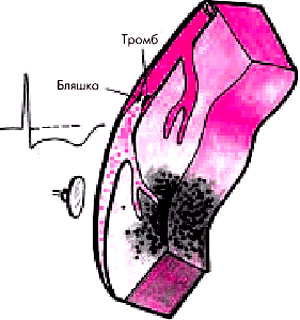
|
 Запомните
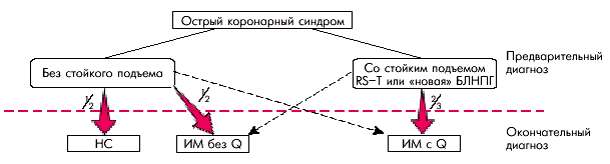
Деление больных острым коронарным синдромом на две категории позволяет прогнозировать исходы остро развившейся ишемии миокарда и оптимизировать способы лечения. Острый коронарный синдром с подъемом сегмента RS–T чаще завершается возникновением трансмурального ИМ с зубцом Q, а острый коронарный синдром без подъема сегмента RS–T — ИМ без зубца Q или НС (рис. 6.5). Возможны и другие варианты исходов острых коронарных синдромов, обозначенные на рисунке пунктирными линиями. Запомните
Деление больных острым коронарным синдромом на две категории позволяет прогнозировать исходы остро развившейся ишемии миокарда и оптимизировать способы лечения. Острый коронарный синдром с подъемом сегмента RS–T чаще завершается возникновением трансмурального ИМ с зубцом Q, а острый коронарный синдром без подъема сегмента RS–T — ИМ без зубца Q или НС (рис. 6.5). Возможны и другие варианты исходов острых коронарных синдромов, обозначенные на рисунке пунктирными линиями.
|
|
| Рис. 6.5. Исходы острых коронарных синдромов (по Е. Braunwald в модификации). БЛНПГ — блокада левой ножки пучка Гиса |
6.2. Патогенез острых коронарных синдромов
| 6.2.1. Механизмы дестабилизации атеросклеротической бляшки |

|
Как было показано выше, морфологической основой всех перечисленных вариантов острого коронарного синдрома является “осложненная” атеросклеротическая бляшка, оболочка которой подвергается повреждению. Разрыв атеросклеротической бляшки или эрозия ее оболочки и последующий стеноз или окклюзия КА происходят под действием ряда факторов, к числу которых относятся:
- aктивное воспаление в оболочке атеросклеротической бляшки;
- “механическая усталость” фиброзной оболочки бляшки;
- кровоизлияние внутри бляшки из-за разрыва vasa vasorum;
- накопление в бляшке большого количества липидов;
- спазм в области “осложненной” атеросклеротической бляшки;
- адгезия и агрегация тромбоцитов и образование тромба.
Активная воспалительная реакцияв атеросклеротической бляшке является, по-видимому, одним из ведущих факторов, ослабляющих фиброзную капсулу бляшки и способствующих ее разрыву. Фиброзная оболочка атеросклеротической бляшки, в состав которой входит большое количество коллагена и эластина, является сравнительно прочным образованием и способна выдерживать достаточно большое напряжение. Ее ослабление происходит в результате местной воспалительной реакции, когда фиброзная оболочка, непосредственно граничащая с просветом сосуда, инфильтрируется макрофагами, пенистыми клетками, Т-лимфоцитами. Риск разрыва атеросклеротической бляшки существенно увеличивается, если количество макрофагов и других клеток в оболочке превышает 15% от общей поверхности бляшки.
Макрофаги, как известно, продуцируют цитокины, в том числе γ-интерферон, интерлейкин 1, фактор некроза опухолей α (ФНОα), которые:
- уменьшают способность гладкомышечных клеток образовывать коллаген;
- подавляют пролиферацию гладкомышечных клеток и индуцируют их запрограммированную гибель (апоптоз);
- стимулируют протеолитическую активность макрофагов.
Макрофаги вырабатывают протеолитические ферменты — металлопротеиназы (коллагеназу, эластазу, желатиназу, стромелизин и др.), которые способствуют разрушению коллагена и эластина фиброзной оболочки и повреждению ее внеклеточного матрикса (рис. 6.6). Одним из мощных стимуляторов воспаления являются окисленные (модифицированные) ЛНП и ЛП (α), которые освобождаются в большом количестве в результате гибели макрофагов и пенистых клеток. Ослабление и разрыв фиброзной капсулы под действием протеолитических ферментов, выделяемых макрофагами, получили название “активного разрыва” бляшки.
| Рис. 6.6. Активное воспаление в атеросклеротической бляшке и повреждение экстрацеллюлярного матрикса фиброзной оболочки | 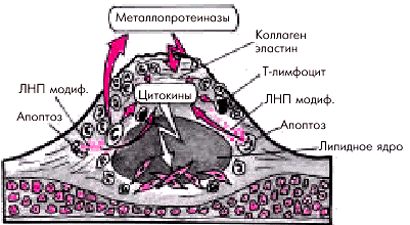
|
“Механическая усталость” фиброзной оболочки. Оболочка атеросклеротической бляшки постоянно подвергается сжатию и растяжению во время сокращения сердца. Этот эффект усиливается при тахикардии, повышении АД, ускорении кровотока, а также при воздействии других гемодинамических факторов. Ослаблению оболочки способствует также наличие большого и все увеличивающегося липидного ядра бляшки, истончение оболочки. Имеет значение форма и локализация атеросклеротической бляшки: чаще подвергаются разрыву бляшки, эксцентрически расположенные в просвете сосуда. Особенно часто гемодинамически обусловленные надрывы происходят в области, непосредственно граничащей с интактным эндотелием (рис. 6.7).
| Рис. 6.7. Гемодинамически обусловленные надрывы оболочки атеросклеротической бляшки | 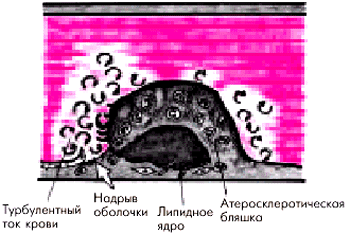
|
Следует помнить, что причиной острого коронарного синдрома может быть не только разрыв оболочки, но и эрозия эндотелия бляшки которая, по данным аутопсий, встречается почти в половине случаев внезапной сердечной смерти и у 25% больных острым ИМ. Особенно часто эрозия бляшки как причина острого коронарного синдрома встречается у женщин.
Кровоизлияние внутри бляшки.В главе 4 было показано, что в процессе формирования атеросклеротической бляшки в ней постепенно образуются микрососуды, которые отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки. В результате кровоизлияний внутри бляшки резко увеличиваются ее размеры и повреждается оболочка.
Спазм коронарной артериив области поврежденной атеросклеротической бляшки существенно ограничивает коронарный кровоток, способствуя возникновению динамического стеноза или динамической окклюзии (рис. 6.8). На рисунке видно, что практически полное прекращение кровотока по артерии может наступить при уменьшении радиуса артерии всего на 20%, даже если органическое сужение до возникновения спазма не превышало 50% просвета сосуда.
Причиной характерного для острого коронарного синдрома спазма КА является в первую очередь выраженная дисфункция эндотелия со снижением продукции дилатирующих субстанций (NO, простациклина и др.) и преобладанием вазоконстрикторов (эндотелина, ангиотензина II и др.). Решающее значение в возникновении выраженного и длительного спазма КА имеют тромбоциты, агрегация которых приводит к высвобождению ряда веществ, обладающих выраженным вазоконстрикторным действием (тромбоксана А2, тромбина и др.). Не исключено, что спазм КА может выполнять роль своеобразного триггера разрыва атеросклеротической бляшки.
| Рис. 6.8. Влияние спазма коронарной артерии на суммарный просвет венечного сосуда в норме (а) и при различных степенях органического сужения артерии (б, в) | 
|
 Запомните
Основными факторами, способствующими разрыву атеросклеротической бляшки, являются: 1. Воспалительная реакция в области оболочки, сопровождающаяся ее инфильтрацией макрофагами, Т-лимфоцитами и пенистыми клетками и уменьшением количества гладкомышечных клеток, что вызывает снижение синтеза и разрушение коллагена и эластина, составляющих основу внеклеточного матрикса фиброзной оболочки бляшки. 2. “Механическая усталость” оболочки бляшки. 3. Особенности структуры самой атеросклеротической бляшки (объем липидного ядра более 40%, тонкая и рыхлая фиброзная капсула, эксцентрическое расположение бляшки и др.). 4. Воздействие гемодинамических факторов (тахикардии, повышения АД, ускорения кровотока, например при физическом или эмоциональном стрессе и др.). 5. Увеличение количества окисленных ЛНП и ЛП (α), индуцирующих воспалительную реакцию. Запомните
Основными факторами, способствующими разрыву атеросклеротической бляшки, являются: 1. Воспалительная реакция в области оболочки, сопровождающаяся ее инфильтрацией макрофагами, Т-лимфоцитами и пенистыми клетками и уменьшением количества гладкомышечных клеток, что вызывает снижение синтеза и разрушение коллагена и эластина, составляющих основу внеклеточного матрикса фиброзной оболочки бляшки. 2. “Механическая усталость” оболочки бляшки. 3. Особенности структуры самой атеросклеротической бляшки (объем липидного ядра более 40%, тонкая и рыхлая фиброзная капсула, эксцентрическое расположение бляшки и др.). 4. Воздействие гемодинамических факторов (тахикардии, повышения АД, ускорения кровотока, например при физическом или эмоциональном стрессе и др.). 5. Увеличение количества окисленных ЛНП и ЛП (α), индуцирующих воспалительную реакцию.
| ||
| 6.2.2. Тромбоз | ||

| ||
Образование тромба в области разрыва или эрозии атеросклеротической бляшки является решающим событием в общей последовательности формирования острых коронарных синдромов. Процесс образования тромба претерпевает несколько стадий.
Первичный тромбоцитарно-сосудистый гемостаз
Обнажение субэндокардиальных структур в области атеросклеротической бляшки (коллагена, фактора Виллебранда, фибронектина, ламинина) способствует усиленной адгезии и агрегации тромбоцитов с образованием на поверхности поврежденной эрозированной атеросклеротической бляшки “белого” тромбоцитарного тромба.
Механизмы адгезии и агрегации тромбоцитов и образования тромбоцитарного сгустка подробно обсуждались в главе 5. Напомним, что основными факторами, определяющими процесс агрегации кровяных пластинок являются:
- тромбоксан А2 (активация метаболизма арахидоновой кислоты в тромбоцитах);
- тромбин;
- АДФ;
- серотонин;
- гликопротеиновые Iа, Ib рецепторы тромбоцитов, обеспечивающие адгезию и первоначальную агрегацию кровяных пластинок;
- гликопротеиновые IIb/IIIа рецепторы тромбоцитов, взаимодействие которых с фибриногеном на заключительном этапе агрегации тромбоцитов приводит к формированию относительно плотного тромбоцитарного тромба.
Вторичный, или коагуляционный, гемостаз
Вторичный, или коагуляционный, гемостаз обеспечивает плотную закупорку поврежденных сосудов так называемым “красным” тромбом, состоящим из сети волокон фибрина с захваченными ею клетками крови (тромбоцитами, эритроцитами и др.). Весь процесс свертывания крови, протекающий с участием специфических факторов свертывания (табл. 6.1), принято условно разделять на две основные фазы:
Таблица 6.1
Факторы свертывания крови (ФС) (по Р. Шмидту и Г. Гевсу в модификации)
| ФС | Название | Свойства |
| I | Фибриноген | Белок |
| II | Протромбин | α1-глобулин |
| III | Тканевой тромбопластин | Фосфолипопротеиды |
| IV | Ионы Са2+ | |
| V | Проакцелерин | β-глобулин |
| VII | Проконвертин | α-глобулин |
| VIII | Антигемофильный глобулин А (АГГ) в комплексе с фактором Виллебранда | β2-глобулин |
| IX | Фактор Кристмаса | α1-глобулин |
| Х | Фактор Стюарта–Прауэра | α1-глобулин |
| ХI | Плазменный предшественник тромбопластина (ППТ) | γ-глобулин |
| ХII | Фактор Хагемана | β-глобулин |
| ХIII | Фибринстабилизирующий фактор | β-глобулин |
| – | Прекалликреин (ПК), фактор Флетчера | β-глобулин |
| – | Высокомолекулярный кининоген (ВМК), фактор Фитцжеральда | α1-глобулин |
1. Фаза активации — многоступенчатый этап свертывания, завершающийся активизацией протромбина (фактор II) с превращением его в активный фермент тромбин (фактор IIа).
2. Фаза коагуляции — конечный этап свертывания, в результате которого под влиянием тромбина фибриноген (фактор I) превращается в фибрин.
Фаза активации. Центральным звеном сложных химических превращений этой фазы является образование так называемого “активатора протромбина”, который представляет собой ферментный комплекс, состоящий из активизированных факторов свертывания Ха, Va, ионов Са2+ и фосфолипопротеинов (рис. 6.9). Источником последних могут быть:
- фосфолипопротеины, высвобождающиеся при повреждении тканей, в частности эндотелия сосудов или соединительной ткани (тканевой тромбопластин — фактор III);
- фосфолипопротеины мембран тромбоцитов, выходящие в плазму при их разрушении (тромбоцитарный фактор 3).
Таким образом, формирование ключевого ферментного комплекса этой фазы — “активатора протромбина” — происходит двумя путями, в соответствие с которыми различают две системы свертывания.
1. Внешняя система, которая активируется при повреждении тканей в течение нескольких секунд. Фосфолипопротеины, выходящие из тканевых клеток (тканевой тромбопластин, или фактор III), в присутствии ионов Са2+ активируют фактор VII (проконвертин). Последний в комплексе с фосфолипопротеинами поврежденной ткани и ионами Са2+ в свою очередь активирует фактор Х, входящий затем в состав “активатора протромбина”.
2. Внутренняя система, активация которой происходит несколько медленнее (в течение минут) и без участия тканевого тромбопластина. Пусковым фактором этого механизма является фактор XII (фактор Хагемана), который активируется двумя путями:
- при контакте крови с коллагеном субэндотелия поврежденного сосуда или с любой чужеродной поверхностью (стеклом, металлом, каолином и т.д.);
- при ферментативном расщеплении фактора Хагемана протеолитическими ферментами (калликреином, тромбином, трипсином и др.) с участием высокомолекулярного кининогена (ВМК).
Фактор ХIIа активирует фактор XI. Последний в свою очередь активирует фактор IX. Наконец, фактор IХа образует ферментный комплекс с фосфолипопротеинами, высвобождающимися при разрушении тромбоцитов (т.е. с тромбоцитарным фактором 3), который в присутствии ионов Са2+ и плазменного фактора VIIIа (фактора Виллебранда) активирует фактор X. Последний также входит в состав “активатора протромбина”. Образовавшийся двумя путями ключевой ферментный комплекс — “активатор протромбина” — протеолитически расщепляет неактивный предшественник протромбин (фактор II) (молекулярная масса 72 000), в результате чего образуется активный протеолитический фермент тромбин (молекулярная масса 35 000), представляющий собой пептидазу. Действие тромбина не ограничивается только протеолизом фибриногена на следующем этапе свертывания крови. Тромбин способствует также необратимой агрегации тромбоцитов (см. выше), а также активирует ряд факторов свертывания (V, VIII, XIII).
Фаза коагуляции.В течение этой фазы происходит образование фибрина из его предшественника фибриногена (см. рис. 6.9). Процесс этот протекает в два этапа. На первом из них фибриноген расщепляется тромбином на четыре растворимых мономера фибрина (по два пептида А и В), у каждого из которых имеется по 4 свободные связи. На втором этапе мономеры соединяются друг с другом, формируя полимеры, из которых строятся волокна фибрина. Процесс необратимой полимеризации фибрина происходит с участием фибриностабилизирующего фактора XIII в присутствии ионов Са2+.
Однако на этой стадии трехмерная сеть волокон фибрина, которая содержит эритроциты, тромбоциты и другие клетки крови, все еще относительно рыхлая. Свою окончательную форму она принимает после ретракции сгустка, возникающей при активном сокращении волокон фибрина и выдавливании сыворотки. Благодаря ретракции сгустка он становится более плотным и стягивает края раны.

|
| Рис. 6.9. Схема свертывания крови. Красными стрелками обозначена активация факторов свертывания, черными — превращения. Римские цифры в кружочках с ровными контурами обозначают неактивированные факторы свертывания, в кружочках с неровными контурами — активированные факторы свертывания |
 Запомните
Выраженность тромбоза в месте разрыва атеросклеротической бляшки и продолжительность его существования определяют, в какой форме будет протекать в дальнейшем острый коронарный синдром: НС, ИМ без зубца Q или ИМ с зубцом Q. При нестабильной стенокардии нередко происходит самопроизвольный тромболизис и компенсаторная дилатация резистивных коронарных сосудов. В результате коронарный кровоток постепенно восстанавливается и наступает ремиссия. Если внутрикоронарный тромб более устойчив к действию компенсаторных механизмов, а период резкого ограничения кровотока и даже окклюзии КА сохраняется более длительное время (до 1 ч), развивается нетрансмуральный ИМ без зубца Q. Наконец, если КА окклюзируется хорошо фиксированным прочным тромбом (смешанным или “красным”, фибринным), развивается трансмуральный ИМ с зубцом Q. Запомните
Выраженность тромбоза в месте разрыва атеросклеротической бляшки и продолжительность его существования определяют, в какой форме будет протекать в дальнейшем острый коронарный синдром: НС, ИМ без зубца Q или ИМ с зубцом Q. При нестабильной стенокардии нередко происходит самопроизвольный тромболизис и компенсаторная дилатация резистивных коронарных сосудов. В результате коронарный кровоток постепенно восстанавливается и наступает ремиссия. Если внутрикоронарный тромб более устойчив к действию компенсаторных механизмов, а период резкого ограничения кровотока и даже окклюзии КА сохраняется более длительное время (до 1 ч), развивается нетрансмуральный ИМ без зубца Q. Наконец, если КА окклюзируется хорошо фиксированным прочным тромбом (смешанным или “красным”, фибринным), развивается трансмуральный ИМ с зубцом Q.
|
Следует, правда, заметить, что нередко в клинической практике наблюдаются исключения из этого правила. Так например, у 1/4 больных нетрансмуральным ИМ без зубца Q при ангиографии выявляется полная окклюзия КА, а перфузия миокарда, относящегося к бассейну окклюзированной КА, осуществляется через хорошо развитые коллатерали. Наоборот, пристеночный тромбоз, формирование которого сопровождается выраженным и длительным спазмом КА, может привести к развитию трансмурального ИМ с зубцом Q, если коллатеpали не выражены.
| 6.3. Нестабильная стенокардия |

|
Термин “нестабильная стенокардия” (НС), предложенный Н. Fovler (1971) и С. Conty с соавт. (1973), используется в настоящее время для обозначения наиболее тяжелого периода течения ИБС, для которого характерно быстрое прогрессирование коронарной недостаточности и высокий риск развития ИМ и внезапной сердечной смерти (до 15–20% в течение 1 года). Выделение этой формы ИБС, несомненно, имеет большое практическое значение, так как нацеливает врача на возможно более раннее выявление и интенсивное лечение больных с высоким риском возникновения фатальных осложнений.
К нестабильной стенокардии относят следующие клинические формы.
1. Впервые возникшая стенокардия нестабильного течения (в течение 1 мес после возникновения первого приступа стенокардии).
2. Прогрессирующая стенокардия напряжения (внезапное увеличение частоты, тяжести, продолжительности приступов стенокардии напряжения в ответ на обычную для данного больного физическую нагрузку, снижение эффективности нитроглицерина и других лекарственных средств, ранее с успехом применявшихся пациентом).
3. Тяжелые и продолжительные приступы стенокардии покоя (более 15–20 мин), в том числе тяжелые случаи спонтанной (вариантной) стенокардии.
4. Ранняя постинфарктная и послеоперационная (после аортокоронарного шунтирования, транслюминальной ангиопластики и т.д.) стенокардия.
В ряде случаев к НС могут быть отнесены и другие формы ИБС, описанные в предыдущей главе, например БИМ и микроваскулярная форма стенокардии, тяжелые и продолжительные приступы вазоспастической стенокардии Принцметала.
 Запомните
1. Различные варианты нестабильной стенокардии представляют собой клинические проявления выраженного обострения ИБС, сопровождающегося не только кратковременной ишемией миокарда, но и его дистрофическими изменениями, а иногда и микронекрозами, высоким риском возникновения ИМ и внезапной сердечной смерти. 2. Морфологической основой нестабильной стенокардии является “осложненная” атеросклеротическая бляшка, на поврежденной поверхности которой (оболочке) формируется тромбоцитарный (“белый”), чаще пристеночный, тромб. 3. Основными патогенетическими факторами, ограничивающими коронарный кровоток при нестабильной стенокардии, являются: Запомните
1. Различные варианты нестабильной стенокардии представляют собой клинические проявления выраженного обострения ИБС, сопровождающегося не только кратковременной ишемией миокарда, но и его дистрофическими изменениями, а иногда и микронекрозами, высоким риском возникновения ИМ и внезапной сердечной смерти. 2. Морфологической основой нестабильной стенокардии является “осложненная” атеросклеротическая бляшка, на поврежденной поверхности которой (оболочке) формируется тромбоцитарный (“белый”), чаще пристеночный, тромб. 3. Основными патогенетическими факторами, ограничивающими коронарный кровоток при нестабильной стенокардии, являются:
| ||
| 6.3.1. Клиническая картина | ||

| ||
Выше было показано, что к НС относятся несколько клинических форм ИБС, каждая из которых отличается существенными клиническими особенностями. Примерно у 2/3 больных НС наблюдаются затяжные приступы стенокардии покоя. На долю прогрессирующей стенокардии напряжения и впервые возникшей стенокардии приходится оставшаяся 1/3 случаев.
 Запомните
При постановке диагноза НС необходимо ориентироваться не столько на нозологическую принадлежность к той или иной форме ИБС, сколько на главный и единственный общий клинический критерий различных вариантов НС — быстро меняющийся характер, интенсивность и длительность болевых приступов, прогрессирующее снижение толерантности к физической нагрузке, а также эффективности обычной для данного больного антиангинальной терапии. Запомните
При постановке диагноза НС необходимо ориентироваться не столько на нозологическую принадлежность к той или иной форме ИБС, сколько на главный и единственный общий клинический критерий различных вариантов НС — быстро меняющийся характер, интенсивность и длительность болевых приступов, прогрессирующее снижение толерантности к физической нагрузке, а также эффективности обычной для данного больного антиангинальной терапии.
|
Впервые возникшая стенокардия
Впервые возникшая стенокардия (ВВС) диагностируется в тех случаях, когда приступы стенокардии напряжения и/или покоя впервые появились у пациента не более 1 месяца назад. Поначалу приступы могут напоминать боли при стабильной стенокардии напряжения. В типичных случаях приступы болей возникают на фоне физической или психоэмоциональной нагрузки, особенно в холодную и ветреную погоду, локализуются за грудиной, иррадиируют в левую руку, лопатку, плечо. Длительность боли, как правило, не превышает 1–5 мин. Боль купируется нитроглицерином и/или прекращением действия провоцирующих факторов.
Однако очень скоро часть больных с ВВС замечают, что приступы ангинозных болей повторяются все чаще и становятся все более интенсивными и продолжительными. На протяжении короткого времени (1–4 недели) они приводят к заметному снижению толерантности к физической нагрузке. Иногда боли появляются в покое и сопровождаются чувством нехватки воздуха, резкой слабостью, потливостью, головокружением. Следует помнить, что каждый такой ангинозный приступ у больных с описанным нестабильным течением ВВС может закончиться развитием ИМ или даже внезапной смертью.
Строго говоря, ВВС не является синонимом НС и не всегда может быть связана с осложненной атеросклеротической бляшкой. В этих случаях ВВС характеризуется более “спокойным” стабильным течением: приступы стенокардии, хотя и рецидивируют, но провоцируются обычно значительным физическим или психоэмоциональным напряжением, толерантность больных длительное время не снижается. При этом с самого начала имеет место медленно формирующийся стеноз КА, который на определенном этапе становится лишь гемодинамически значимым и проявляется впервые возникшей стенокардией напряжения, которая сразу носит стабильный характер (П.Х. Джанашия с соавт.). Через 1–1,5 месяца от начала заболевания такое течение ИБС расценивается как стабильная стенокардия напряжения.
Тем не менее характер дальнейшего течения ВВС (стабильный или нестабильный) у пациента с недавно появившимися ангинозными приступами предсказать очень трудно. Поэтому каждый такой случай требует от врача самого пристального внимания к развитию всех симптомов болезни. Несомненно, что каждый больной с ВВС должен наблюдаться в кардиологическом стационаре, где ему может быть оказана своевременная медицинская помощь и проведено соответствующее обследование (см. ниже).
Рассматривая особенности болевого синдрома при ВВС как стабильного, так и нестабильного течения, следует иметь в виду сравнительно высокую частоту возникновения у этих больных, особенно у лиц молодого возраста, атипичной стенокардии, напоминающей клинику вегетативной дисфункции. Боли в области сердца могут иметь значительную продолжительность, нередко локализуются не за грудиной, а в области верхушки сердца, слева от грудины или в эпигастрии, часто провоцируются не физической нагрузкой, а возникают как бы спонтанно, что подчеркивает значение динамической окклюзии коронарной артерии, обусловленной ее спазмом.
Прогрессирующая стенокардия напряжения
Прогрессирующая стенокардия напряжения (ПС) всегда расценивается как НС. Она возникает, как правило, у больных с более или менее длительным анамнезом стабильной стенокардии напряжения, свидетельствуя об “обострении” заболевания. Для диагностики ПС следует ориентироваться, прежде всего, на качественно изменившийся характер болевого синдрома:
1. У больных происходит значительное учащение и увеличение длительности и интенсивности приступов стенокардии напряжения.
2. Болевые приступы провоцируются все меньшей физической или психоэмоциональной нагрузкой, свидетельствуя об изменении функционального класса стенокардии (III ФК).
3. К стенокардии напряжения присоединяются приступы стенокардии покоя (если их не было ранее) (IV ФК).
4. Заметно снижается эффективность нитроглицерина и других антиангинальных препаратов, ранее использовавшихся больными для купирования или профилактики стенокардии.
Стенокардия покоя
Тяжелые и продолжительные приступы стенокардии покоя (если они не выявлялись ранее у данного пациента) представляют собой один из наиболее опасных в прогностическом отношении клинических вариантов НС. По некоторым данным, частота развития ИМ в течение 1–2 месяцев от момента возникновения первых таких ангинозных приступов достигает 40–50%, а летальность — 11–15%.
По сути эта форма может выявляться как у больных с прогрессирующей стенокардией напряжения (в тех случаях, когда к стенокардии напряжения присоединяются приступы стенокардии покоя), так и у пациентов с ВВС и стенокардией Принцметала. Возможно также внезапное появление подобных болевых приступов на фоне относительно стабильного течения заболевания.
Эта форма НС клинически проявляется повторными и тяжелыми приступами стенокардии покоя продолжительностью более 15–20 минут. Интенсивная загрудинная боль нередко сопровождается остро наступающей слабостью, потливостью, одышкой, преходящими нарушениями ритма и проводимости и/или внезапным снижением АД. Боль, как правило, появляется в покое, без предшествующих нагрузок, и становится все более рефрактерной к нитроглицерину. Для ее купирования нередко требуется применение наркотических анальгетиков. Толерантность к физической нагрузке при этом резко падает.
Тяжелые и частые приступы спонтанной (вариантной) стенокардии Принцметала также относятся к прогностически весьма неблагоприятной форме НС. По данным некоторых авторов, у 1/4 - 1/2 больных со спонтанной вариантной стенокардией в течение ближайших 2–3 месяцев развивается ИМ или внезапная сердечная смерть.
Ранняя постинфарктная стенокардия
Ранняя постинфарктная стенокардия, возникающая в период от 48 ч до 2 недель от начала острого ИМ, по своему прогностическому значению также относится к НС. Возобновление ангинозных приступов в раннем постинфарктном периоде существенно ухудшает как ближайший, так и отдаленный прогноз ИМ: к концу первого года частота рецедивов ИМ достигает 50%, а летальность — 17%. Ранняя постинфарктная стенокардия, как правило, свидетельствует о неполном тромболизисе в окклюзированной КА и о продолжающемся формировании тромба, в том числе и в других сосудистых областях, если имеет место многососудистое поражение КА.
Клинически ангинозная боль у этих больных мало чем отличается от обычной стенокардии, причем встречаются как случаи тяжелой стенокардии покоя и/или малых нагрузок, рефрактерных к антиангинальной терапии, так и случаи неинтенсивных ангинозных болей, провоцируемых лишь чрезмерной физической нагрузкой. Однако во всех этих случаях раннее возобновление стенокардии у больного с ИМ расценивается как НС.
Дата добавления: 2015-08-04; просмотров: 719;
