Ультразвуковая допплерография артерий нижних конечностей 3 страница
| 5.4.3. Эфферентная терапия |

|
При значительных нарушениях липидного обмена, связанных, например, с генетически обусловленными дефектами ЛНП-рецепторов гепатоцитов, применение описанных гиполипидемических препаратов по понятным причинам оказывается малоэффективным. В этих случаях показано применение различных методов эфферентной терапии:
- энтеросорбции;
- гемосорбции;
- ЛНП-иммуносорбции и др.
Энтеросорбция — это метод гиполипидемической терапии, основанный на применении специальных энтеросорбентов, на которых при их приеме внутрь осаждается значительное количество ХС или ТГ. Обычно применяются углеродные или сферические аффинные энтеросорбенты. Рекомендуют 2–4-х недельные курсы энтеросорбции 3–4 раза в год. По некоторым данным, в результате такой терапии может существенно (на 20–30%) снижаться уровень общего ХС, ХС ЛНП и ТГ (Ю.М. Лопухин).
Гемосорбция — метод очищения крови при пропускании ее через специальные активированные сорбенты. Применение сорбентов различных классов позволяет добиться значительного снижения уровня общего ХС и ХС ЛНП, в частности за счет очищения мембран эритроцитов и тромбоцитов, содержащих большое количество ХС. К сожалению, несмотря на хороший клинический эффект, метод требует регулярного повторения сеансов гемосорбции.
ЛНП-иммуносорбция — это метод удаления из плазмы крови ЛНП с использованием специфических иммуносорбентов. После сепарации крови пациента на клеточные элементы и плазму, последняя пропускается через иммуносорбционную колонку, содержащую моноспецифические поликлональные антитела против ЛНП. В результате происходит очищение плазмы от значительных количеств ЛНП, тогда как ЛВП свободно проникают через иммуносорбционную колонку. Таким образом можно удалить до 50% всех атерогенных ЛП.
Методы эфферентной терапии пока не нашли широкого распространения в клинической практике для лечения больных атеросклерозом, в частности благодаря высокой стоимости описанных процедур очищения крови. Тем не менее в некоторых случаях семейных наследственных ГЛП эти методы являются единственным способом добиться успеха лечения.
| Глава 5. Хроническая ишемическая болезнь сердца |

|
Ишемическая болезнь сердца (ИБС) — это заболевание миокарда, обусловленное острым или хроническим несоответствием потребности миокарда в кислороде и реального коронарного кровоснабжения сердечной мышцы, которое выражается в развитии в миокарде участков ишемии, ишемического повреждения, некрозов и рубцовых полей и сопровождается нарушением систолической и/или диастолической функции сердца (рис. 5.1).

|
| Рис. 5.1. Соотношение потребности миокарда в кислороде и реального кровоснабжения при ИБС (по F.J. Kloke, A.K. Ellis, 1998 в модификации). MVO 2 — потребление миокардом кислорода; CBF (coronary blood flow) — объем коронарного кровотока; (A –V)O2 – артериовенозная разница по кислороду |
ИБС является одним из наиболее распространенных заболеваний сердечно-сосудистой системы во всех экономически развитых странах. По данным проспективных исследований, ИБС страдают около 5–8% мужчин в возрасте от 20 до 44 лет и 18–24,5% — в возрасте от 45 до 69 лет. Распространенность ИБС у женщин несколько меньше и в старшей возрастной группе обычно не превышает 13–15%. На долю ИБС приходится более половины всех смертей от сердечно-сосудистых заболеваний. В Российской Федерации отмечается один из наиболее высоких в Европе показателей распространенности и смертности населения от ИБС. Следует учитывать также большую социально-экономическую значимость ИБС, которая приводит к относительно ранней потере трудоспособности и инвалидизации больных.
По выражению Stamler (1973): “…ИБС достигла такой распространенности, …что в последующие годы приведет человечество к величайшей эпидемии, если мы не будем в состоянии изменить эту тенденцию путем настойчивых исследований по выяснению причин возникновения и путей профилактики этого заболевания…”.
Наиболее характерным клиническим признаком ИБС является стенокардия (angina pectoris — грудная жаба). Первое описание классической стенокардии принадлежит Гебердену (1772), который для ее обозначения впервые применил термин “angina pectoris” (грудная жаба). Однако еще Гиппократ, а затем Бартолетти (1576–1630), Гарвей (1527–1658), Морганьи (1684–1771) описывали случаи возникновения у пожилых и старых людей сильных острых болей в левой половине грудной клетки, сопровождавшихся беспокойством, страхом, удушьем, обмороком во время приступа. Parry (1799) первым указал на связь стенокардии с изменением структуры сердца и поражением КА. Он же первым высказал предположение, что ангинозная (стенокардитическая) боль возникает вследствие уменьшения снабжения сердца кровью.
Большинство врачей, еще задолго до Гебердена описывавших подобные ангинозные приступы, подчеркивали их связь с внезапной сердечной смертью. Гиппократ указывал, что “…боль в области сердца, которая появляется с определенной частотой у старых людей является предзнаменованием внезапной смерти…”.
| 5.1. Этиология |

|
Атеросклероз. Морфологической основой ИБС более чем в 95–97% случаев является атеросклерозкоронарных артерий (КА). Атеросклеротические бляшки, суживающие просвет венечных сосудов, локализуются главным образом в проксимальных (эпикардиальных) КА, преимущественно в области их устья (рис. 5.2). При этом интрамуральные венечные сосуды, по крайней мере, макроскопически, остаются интактными.
| Рис. 5.2. Атеросклеротические бляшки в проксимальном отделе передней межжелудочковой ветви (ПМЖВ) левой коронарной артерии (ЛКА). ОВ — огибающая ветвь ЛКА | 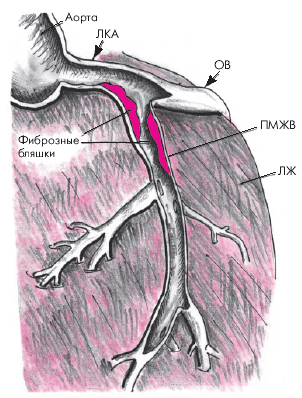
|
Напомним, что передняя межжелудочковая ветвь левой коронарной артерии (ПМЖВ ЛКА) кровоснабжает всю переднюю стенку ЛЖ и большую часть МЖП. Огибающая ветвь ЛКА (ОВ ЛКА) обеспечивает кровоснабжение боковой и задней стенок ЛЖ, а правая коронарная артерия (ПКА) — заднедиафрагмальную (нижнюю) стенку ЛЖ, базальную часть МЖП и ПЖ, а также АВ–узел (см. главу 1). Атеросклеротические изменения коронарного русла приводят к возникновению преходящей или постоянной ишемии и другим последствиям нарушения коронарного кровотока в бассейне пораженной артерии.
Степень атеросклеротического сужения трех наиболее крупных КА (ПМЖВ, ОВ и ПКА) у больных ИБС, как правило, неодинакова. Поражение одной из них (ПМЖВ, ОВ или ПКА) обнаруживают примерно в 30% случаев, двух КА — еще у трети больных и трех КА — у остальных больных. Таким образом, примерно у 2/3 больных ИБС при коронароангиографии (или на аутопсии) можно обнаружить 2–3-х сосудистое поражение КА, которое отличается наиболее серьезным прогнозом. Чаще всего поражается ПМЖВ, которая кровоснабжает значительную часть ЛЖ. Нарушение кровотока в ПМЖВ отличается высоким риском возникновения ИМ и внезапной смерти. Еще более тяжелый прогноз отмечен при атеросклеротическом сужении или окклюзии ствола ЛКА.
“Синдром Х”. Следует подчеркнуть, что примерно у 10–15% больных с типичной клинической картиной ИБС и верифицируемыми объективными признаками преходящей ишемии миокарда явного атеросклеротического сужения крупных проксимальных КА не обнаруживают вообще. Такой вариант течения ИБС получил название “синдром Х”. Его возникновение связывают с поражением мелких коронарных артерий, которые не визуализируются при коронароангиографии (подробнее см. ниже).
Другие причины. Нередко, особенно в англоязычной литературе, в качестве относительно редких причин ИБС называют некоторые заболевания и синдромы, также сопровождающиеся ишемическими поражениями сердечной мышцы:
- врожденные аномалии развития КА;
- воспалительные коронарииты, обусловленные вовлечением в патологический воспалительный процесс КА (узелковый периартериит, системные заболевания соединительной ткани и др.);
- сифилитический аортит;
- расслаивающая аневризма грудной аорты;
- эмболия КА (при инфекционном эндокардите, фибрилляции предсердий, ревматических пороках сердца и т.п.);
- аортальные пороки сердца и другие.
Все эти поражения коронарного русла действительно могут сопровождаться развитием преходящей ишемии сердечной мышцы или даже возникновением ИМ. Однако целесообразность их включения в понятие ИБС весьма сомнительна, поскольку это заболевание имеет свою четко очерченную клиническую и патоморфологическую картину, позволяющую выделять ИБС как самостоятельную нозологическую единицу. Большинство из перечисленных поражений коронарного русла, следует, вероятно, рассматривать как осложнение других заболеваний, например, “инфекционного эндокардита с поражением аортального клапана, осложненного тромбоэмболией ПМЖВ с развитием острого инфаркта миокарда”.
Факторы риска ИБС. Следует упомянуть также о значении в формировании ИБС факторов риска (ФР), идентичных ФР атеросклероза, подробно описанным в главе 4. Напомним, что к числу наиболее значимых из них относятся:
1. Немодифицируемые (неизменяемые) ФР:
- возраст старше 50–60 лет;
- пол (мужской);
- отягощенная наследственность.
2. Модифицируемые (изменяемые):
- дислипидемии (повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных ЛВП);
- артериальная гипертензия (АГ);
- курение;
- ожирение;
- нарушения углеводного обмена (гипергликемия, сахарный диабет);
- гиподинамия;
- нерациональное питание;
· гипергомоцистеинемия и др.
В настоящее время доказано, что наибольшее прогностическое значение имеют такие ФР ИБС как дислипидемии, АГ, курение, ожирение и сахарный диабет.
| 5.2.1. Механизмы коронарной недостаточности |

|
Из приведенного выше определения ИБС следует, что возникновению коронарной недостаточности способствует действие любых органических или функциональных факторов, вызывающих либо прямое ограничение коронарного кровотока и снижение перфузионного давления в коронарной системе, либо значительное увеличение потребности миокарда в кислороде, которое не сопровождается адекватным увеличением коронарного кровотока.
Можно выделить 4 основных механизма острой или хронической коронарной недостаточности.
1. Сужение проксимальных (эпикардиальных) КА атеросклеротической бляшкой с ограничением коронарного кровотока и/или его функционального резерва и невозможностью адекватного расширения венечных сосудов в ответ на увеличение потребности миокарда в кислороде (“фиксированный стеноз”).
2. Выраженный спазм КА (“динамический стеноз”).
3. Тромбоз КА, в том числе образование микротромбов в микроциркуляторном сосудистом русле.
4. Микроваскулярная дисфункция.
В большинстве случаев у больных коронарным атеросклерозом имеет место сочетание действий нескольких из этих механизмов.
Сужение коронарных артерий атеросклеротической бляшкой ("фиксированный стеноз")
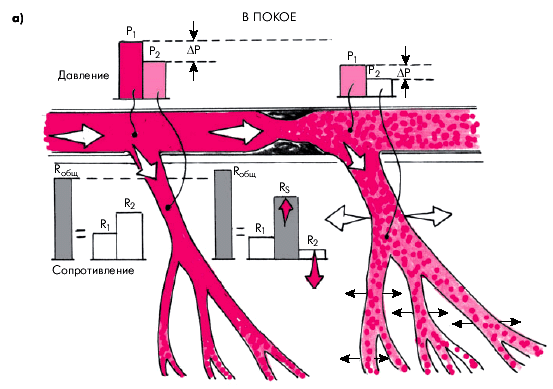
Прогрессирующее сужение проксимальной (эпикардиальной) КА атеросклеротической бляшкой ведет к значительному повышению сопротивления в области стенозированной КА. При этом расположенные дистально от места стеноза интрамуральные резистивные сосуды (артериолы) компенсаторно расширяются, их сопротивление (R2) падает, что при умеренных степенях стеноза способствует сохранению (по крайней мере, в покое) почти нормального общего сопротивления коронарного русла стенозированной артерии (Rобщ) и величины перфузионного давления в ней (рис. 5.3).
|
|
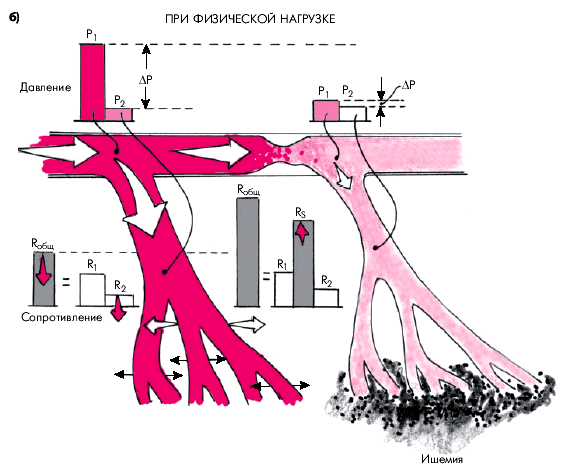
| Рис. 5.3. Изменение сосудистого сопротивления, перфузионного давления и величины кровотока в интактной (слева) и стенозированной (справа) коронарных артериях. а — в покое; б — при физической нагрузке. Объяснение и обозначения в тексте |
На рисунке видно, что общее сосудистое сопротивление (Rобщ), которое оказывает коронарному кровотоку интактная КА (на рис. 5.3, а слева), складывается из сравнительно небольшого сопротивления проксимального участка КА (R1) и сопротивления дистального участка коронарного русла (R2), которое определяется, прежде всего, тонусом резистивных сосудов (артериол). Перфузионное давление (ΔР), под действием которого осуществляется кровоток в системе интактной артерии, равно разнице давления в проксимальном сосуде (Р1) и в ее дистальных отделах (Р2):
ΔP = Р1 – Р2.
В стенозированной КА (на рисунке справа) общее коронарное сопротивление (Rобщ) складывается из сопротивления проксимального участка артерии (R1), сопротивления области стеноза (RS) и сопротивления дистального участка коронарного русла (R2). В покое, несмотря на сужение КА, которое оказывает значительное сопротивление коронарному кровотоку (RS), Rобщ увеличено незначительно, поскольку за счет компенсаторного расширения артериол и мелких артерий величина R2 уменьшается. В постстенотическом участке проксимальной артерии по понятным причинам давление (Р1) снижено, но перфузионное давление (ΔР) остается почти таким же, как в интактной КА за счет резкого уменьшения Р2. При увеличении потребности миокарда в кислороде (физическая нагрузка) в системе интактной КА, сохранившей коронарный резерв, происходит значительное расширение артериол и мелких артерий, и величина сопротивления дистального участка артерии (R2) и Rобщ значительно падает. Это приводит к увеличению градиента давления (DР), и коронарный кровоток увеличивается (рис. 5.3, б). В стенозированном участке на фоне физической нагрузки и возрастания интенсивности кровотока RS увеличивается, тогда как R2 больше не уменьшается, поскольку мелкие сосуды максимально расширены и коронарный резерв исчерпан. В результате величина общего сопротивления (Rобщ) значительно возрастает. Это приводит к еще большему падению постстенотического давления (Р1) при сохранении прежней величины Р2. Поэтому перфузионное давление (DР) и, соответственно, коронарный кровоток уменьшаются до критического уровня, и появляются условия для возникновения ишемии миокарда.
На этой стадии формирования стенозирования КА компенсаторная дилатация интрамуральных резистивных сосудов происходит преимущественно благодаря действию метаболических механизмов саморегуляции коронарного кровотока, в частности повышенной продукции аденозина, эндотелийзависимого фактора расслабления (оксида азота — NО), простациклина PGI2 и др. До поры до времени это обеспечивает сохранение адекватного уровня коронарного кровообращения в покое, хотя и ведет ко все большему ограничению коронарного резерва, т.е. возможности дальнейшего расширения резистивных сосудов при воздействии факторов, увеличивающих потребность миокарда в кислороде. Напомним, что к числу таких факторов относятся:
1. Увеличение напряжения миокарда, определяемого уровнем систолического АД, величиной постнагрузки, диастолическими размерами полости ЛЖ и уровнем КДД в нем.
2. Увеличение ЧСС.
3. Увеличение инотропизма сердечной мышцы, которое чаще всего ассоциируется с активацией САС и повышением концентрации катехоламинов в крови.
Таким образом, на этой стадии развития заболевания клинические и инструментальные признаки преходящей ишемии миокарда возникают главным образом при значительной активации САС, физическом или эмоциональном напряжении, увеличении ЧСС, подъеме АД и т.п.
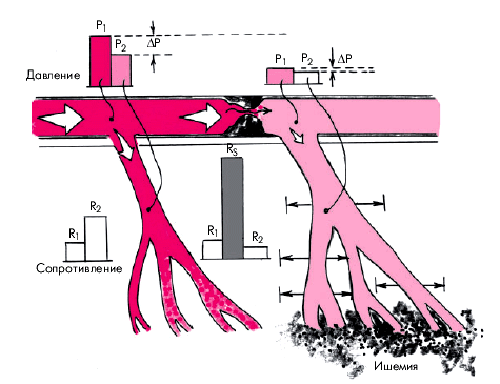
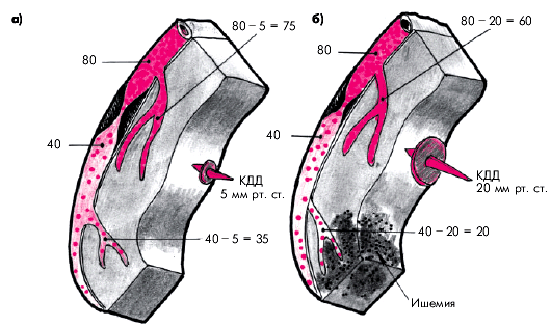
По мере увеличения степени стеноза проксимальной КА возрастает выраженность компенсаторной вазодилатации и одновременно снижается коронарный расширительный резерв. При достижении критической степени стеноза (75–80% от общей площади просвета сосуда) увеличение кровотока в ответ на возрастающую потребность миокарда в кислороде становится невозможным (Е. Braunwald), и признаки КН возникают при незначительной нагрузке или даже в покое (рис. 5.4). Кроме того, при такой степени стеноза и максимальном расширении резистивных венечных сосудов уровень коронарного кровотока становится чрезвычайно зависимым от внутримиокардиального напряжения (или уровня внутрижелудочкового давления). Поэтому любое увеличение КДД ЛЖ, обусловленное, например, падением сократительной способности миокарда у больных с ХСН, дилатацией полости ЛЖ, увеличением преднагрузки, выраженной гипертрофией миокарда или увеличением ЧСС, ведет к сдавлению микроциркуляторного сосудистого русла и еще более резкому ограничению перфузии миокарда в бассейне стенозированной КА (рис. 5.5).
Таким образом, наличие выраженного стеноза проксимальной КА, максимальная дилатация резистивных венечных сосудов и невозможность их дальнейшего расширения, адекватно возросшей потребности миокарда в кислороде являются первыми патогенетическими механизмами возникновения коронарной недостаточности у больных ИБС.
|
| Рис. 5.4. Изменение сосудистого сопротивления, перфузионного давления и величины кровотока при критическом стенозе коронарной артерии |
|
| Рис. 5.5. Влияние конечно-диастолического давления (КДД) в ЛЖ на величину перфузионного давления в дистальных коронарных сосудах (по R.H. Anderson, A.E. Becker, 1992 в модификации). а — нормальное КДД; б — повышение КДД ЛЖ |
Спазм коронарной артерии
Спазм КА у больных ИБС может затрагивать как крупные (эпикардиальные), так и интрамуральные резистивные венечные сосуды. Этот важный механизм коронарной недостаточности связан, главным образом, с нарушением метаболической и нейрогуморальной регуляции коронарного кровотока.
В главе 1 было показано, что в физиологических условиях в ответ на любое усиление метаболизма сердечной мышцы и увеличение потребности миокарда в кислороде происходит высвобождение из клеток сосудистого эндотелия эндотелийзависимого фактора расслабления (оксида азота — NО) и простациклина PGI2, обладающих мощным вазодилатирующим действием и антиагрегантными свойствами. В результате интрамуральные резистивные КА (артериолы) расширяются и коронарный кровоток увеличивается, обеспечивая адекватную перфузию миокарда в условиях возросшей потребности миокарда в кислороде.
Следует также иметь в виду, что компенсаторная релаксация венечных сосудов, вызываемая аденозином, брадикинином, субстанцией Р, ацетилхолином и другими прямыми вазодилататорами также является эндотелийзависимой реакцией.
Таким образом, в основе адекватной физиологической реакции венечных сосудов на любое усиление метаболизма сердечной мышцы лежит прежде всего нормальное функционирование сосудистого эндотелия. Поэтому повреждение эндотелия, которое закономерно наблюдается у больных коронарным атеросклерозом, АГ, сахарным диабетом, гиперлипидемией, ожирением, сопровождается двумя отрицательными последствиями:
- ослаблением эндотелийзависимой релаксации КА, в первую очередь связанным с уменьшением выделения клетками эндотелия оксида азота (NО) и простациклина;
- избыточной продукцией эндотелиальных вазоконстрикторных субстанций (тканевого ангиотензина II, эндотелина, тромбоксана А2, серотонина и др.).
Поврежденный эндотелий КА извращенно и неадекватно реагирует на обычные гемодинамические и гуморальные стимулы. В условиях стенозирования КА эта ситуация усугубляется значительными изменениями гемодинамики в области атеросклеротической бляшки (снижение давления и турбулентный ток крови в постстенотическом участке, увеличение градиента давления между престенотическим и постстенотическим участками КА). В результате активируется тканевой (т.е. продуцируемый самой эндотелиальной клеткой) ангиотензин-превращающий фермент (АПФ) и резко увеличивается высвобождение ангиотензина II. Одновременно возрастает продукция эндотелиальными клетками другого мощного вазоконстриктора — эндотелина, который, связываясь со специфическими рецепторами на мембране гладкомышечных клеток, повышает концентрацию внутриклеточного кальция, вызывает длительное и значительное повышение тонуса сосудистой стенки (рис. 5.6).
| Рис. 5,6. Повреждение эндотелия, обусловленное гемодинамическими факторами (ускорение и турбулентный ток крови), и продукция эндотелиальных вазоконстрикторных факторов. AII — ангиотензин II; E 1 — эндотелин 1; T X A 2 — тромбоксан A 2 ; S — серотонин | 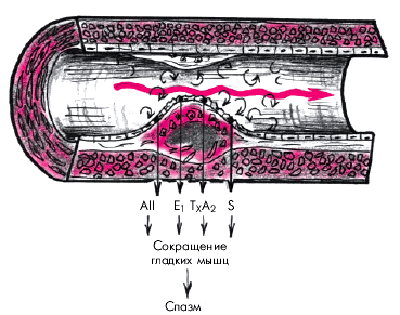
|
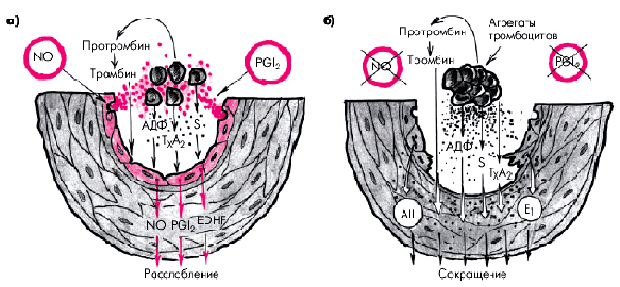
Снижение эндотелиальной продукции PGI2 и NО у больных ИБС имеет следствием не только подавление реактивной вазодилатации венечных сосудов, но и приводит к усилению пристеночной агрегации тромбоцитов. В результате активируется тромбоксановый путь метаболизма арахидоновой кислоты с избыточным образованием тромбоксана А2. Последний, как известно, обладает не только выраженным вазоконстрикторным действием, но и индуцирует дальнейшую агрегацию тромбоцитов и тромбообразование (рис. 5.7).
|
| Рис. 5.7. Эндотелийзависимые субстанции при неповрежденном (а) и поврежденном (б) эндотелии и их влияние на тромбоциты и гладкомышечные клетки |
Важной причиной возникновения вазоконстрикторных реакций атеросклеротически измененных КА у больных ИБС является также нарушение нервной регуляции коронарного кровотока, в частности, значительное преобладание эффектов активации САС и высокой концентрации катехоламинов. Наибольшее значение здесь имеет, вероятно, прямое сосудосуживающее действие катехоламинов, опосредованное α1-адренергическими рецепторами, возбуждение которых вызывает сужение преимущественно крупных (эпикардиальных) КА.
Стимулирование М-холинорецепторов при активации парасимпатической нервной системы оказывает, как известно, сосудорасширяющее действие. Однако нужно учитывать, что эффекты ацетилхолина также опосредуются эндотелием КА.
Таким образом, повышение сосудистого тонуса и спазм КА у больных ИБС является одним из ведущих механизмов возникновения коронарной недостаточности.
 Запомните
Основными причинами повышения тонуса и спазма КА у больных ИБС являются: Запомните
Основными причинами повышения тонуса и спазма КА у больных ИБС являются:
|
Тромбоз
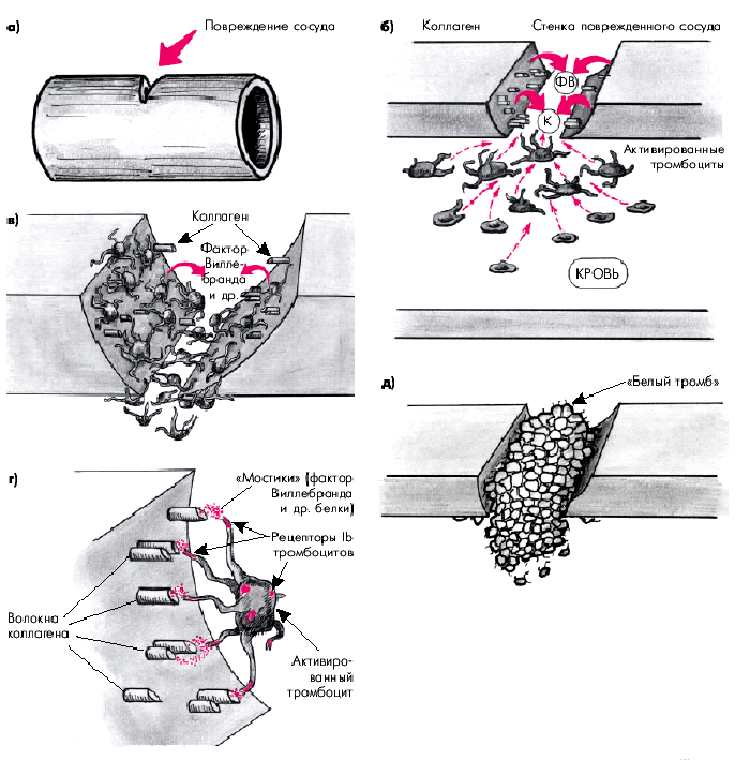
У здорового человека нормальное функционирование системы тромбоцитарно-сосудистого и коагуляционного гемостаза обеспечивает сохранение целостности сосудистой стенки. В норме кровотечение из мелких сосудов при их повреждении останавливается за 1–3 мин. Это происходит главным образом за счет адгезии и агрегации тромбоцитов и, в меньшей степени, спазма микрососудов. Пусковую роль в этом процессе играют повреждение стенок кровеносных сосудов и обнажение субэндотелиальных тканевых структур, в частности, коллагена (рис. 5.8). Под действием коллагена (К) и содержащегося в субэндотелии так называемого фактора Виллебранда (ФВ) происходит быстрая активизация тромбоцитов, которые, изменяя свою форму, набухая и образуя шиповидные отростки (рис. 5.8, б), прилипают (адгезируют) к волокнам соединительной ткани по краям раны (рис. 5.8, в).
Адгезия (прилипание) тромбоцитов к субэндотелию поврежденных кровеносных сосудов является, таким образом, начальным этапом сосудисто-тромбоцитарного гемостаза и связана с взаимодействием трех его компонентов: 1) специфических рецепторов мембран тромбоцитов (гликопротеина Ib, IIb, IIIа и др.); 2) коллагена; 3) фактора Виллебранда. Последний образует своеобразные мостики между коллагеном субэндотелия сосудов и рецепторами тромбоцитов (рис. 5.8, г).
|
| Рис. 5.8. Схемы активации, адгезии и агрегации тромбоцитов при повреждении кровеносного сосуда. а - повреждение сосуда; б - активация тромбоцитов под действием коллагена (К) обнажившихся субэндотелиальных тканевых структур и фактора Виллебранда (ФВ); в- адгезия (прилипание) тромбоцитов к субэндотелию поврежденного сосуда; г - образование «мостиков» между волокнами коллагена и рецепторами Ib тромбоцитов; д -агрегация тромбоцитов и образование тромбоцитарного тромба («белого тромба») |
Одновременно под влиянием АДФ, катехоламинов (КА) и серотонина, выделяющихся из поврежденных клеток, и коллагена повышается способность тромбоцитов к агрегации (рис. 5.9). При этом из тромбоцитов выделяются и начинают действовать вещества, содержащиеся в так называемых электронно-плотных a-гранулах тромбоцитов: большое количество АДФ, серотонин, адреналин, некоторые белки, участвующие в агрегации и свертывании крови (антигепариновый фактор тромбоцитов IV, β-тромбоглобулин, пластиночный фактор роста и некоторые факторы свертывания, аналогичные плазменным — фибриноген, факторы V и VIII, калликреин, α2-антиплазмин и др.).
| Рис. 5.9. Последствия реакции освобождения биологически активных веществ из поврежденной ткани и тромбоцитов. АДФ — аденозиндифосфат; КА — катехоламины; С — серотонин | 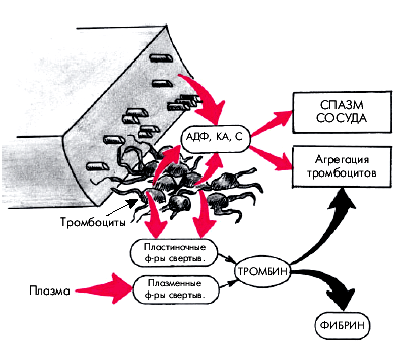
|
 Запомните
Реакция высвобождения биологически активных веществ из тромбоцитов и поврежденных клеток сосудов имеет 2 важных следствия (рис. 5.9): 1. Под влиянием АДФ, серотонина и адреналина резко усиливается процесс агрегации тромбоцитов. 2. Под влиянием серотонина, адреналина и др. возникает спазм поврежденного микрососуда. Запомните
Реакция высвобождения биологически активных веществ из тромбоцитов и поврежденных клеток сосудов имеет 2 важных следствия (рис. 5.9): 1. Под влиянием АДФ, серотонина и адреналина резко усиливается процесс агрегации тромбоцитов. 2. Под влиянием серотонина, адреналина и др. возникает спазм поврежденного микрососуда.
|
В процессе разрушения тромбоцитов из них выделяются некоторые важные факторы свертывания: 1) тромбоцитарный фактор III (тромбопластин); 2) антигепариновый фактор IV; 3) фактор Виллебранда VIII; 4) фактор V; 5) β-тромбоглобулин; 6) ростковый фактор, α2-антиплазмин, фибриноген и др.
Многие из них аналогичны соответствующим плазменным факторам свертывания. Следует, однако, помнить, что тромбоциты, оказывая большое влияние на интенсивность и скорость локального свертывания в зоне тромбообразования, меньшее влияние оказывают на процесс свертывания крови вообще (З.С. Баркаган, 1988). Иными словами, сосудисто-тромбоцитарный и коагуляционный гемостаз являются взаимосвязанными (сопряженными), но все же относительно независимыми процессами.
В результате взаимодействия плазменных и высвобождающихся пластиночных факторов и тканевого тромбопластина начинается процесс свертывания крови (см. рис. 5.9). В зоне первичного гемостаза образуются вначале малые количества тромбина, который, с одной стороны, завершает процесс необратимой агрегации тромбоцитов, а с другой, способствует образованию фибрина, который вплетается в тромбоцитарный сгусток и уплотняет его. Взаимодействие тромбоцитов с фибриногеном осуществляется с помощью специфических рецепторов IIb/IIIа (рис. 5.10). Важную роль в формировании тромбоцитарной агрегации играют производные арахидоновой кислоты — простагландины PGG2 и PGH2 и другие, из которых в тромбоцитах образуется тромбоксан А2, обладающий мощным агрегирующим и сосудосуживающим эффектом, а в сосудистой стенке — простациклин (PGI2), являющийся основным ингибитором агрегации.
Дата добавления: 2015-08-04; просмотров: 1064;
