Исследование других органов 3 страница
|
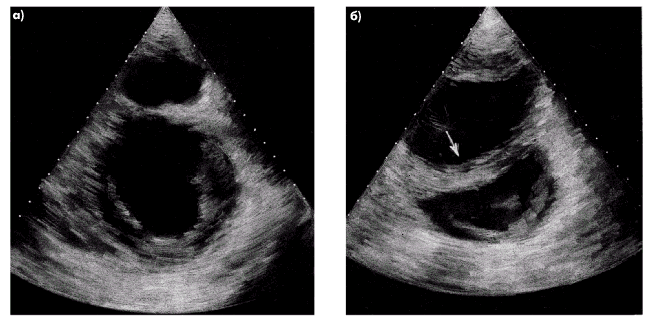
| Рис. 2.33. Двухмерные эхокардиограммы, зарегистрированные в парастернальной позиции по короткой оси в норме (а) и при выраженной дилатации правого желудочка (б). Отмечается изменение нормального соотношения размеров ЛЖ и ПЖ, утолщение передней стенки ПЖ и МЖП, а также парадоксальное движение МЖП в сторону левого желудочка (отмечено стрелкой) |
Косвенное определение давления в легочной артерии
Неинвазивное определение давления в малом круге кровообращения и диагностика легочной артериальной гипертензии необходимы для оценки тяжести течения и прогноза многих заболеваний сердца, в том числе сердечной недостаточности. М-модальное, и особенно двухмерное, ультразвуковое исследование позволяет выявить ряд косвенных признаков, характерных для повышения давления в легочной артерии: 1. Гипертрофию и дилатацию ПЖ (см. ниже).
2. Вторичную недостаточность легочного и трехстворчатого клапанов.
3. Изменение характера движения задней створки клапана легочной артерии.
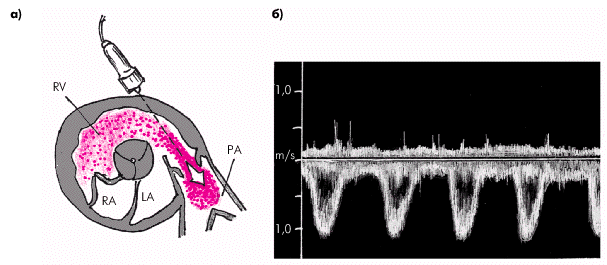
С помощью допплеровского исследования можно выявить наиболее достоверные качественные и количественные признаки гипертензии. Исследование систолического потока через клапан легочной артерии обычно проводят из левого парастернального доступа по короткой оси (рис. 2.34). Основная волна допплеркардиограммы направлена в сторону от ультразвукового датчика и располагается ниже базовой линии спектрограммы. Пик максимальной скорости, как правило, смещен к началу потока и имеет закругленную вершину. По сравнению с аортальным систолическим потоком крови поток в выходном отделе ПЖ и в устье легочной артерии меньшей амплитуды (не более 60–71 см/с) и имеет закругленную вершину.
|
| Рис. 2.34. Допплер-ЭхоКГ потока крови через клапан легочной артерии (PА), зарегистрированная по короткой оси из левого парастернального доступа. а — схема расположения ультразвукового датчика и направления сканирования; б — допплерограмма потока крови. Во время систолы ПЖ определяется систолический пик скорости, направленный вниз |
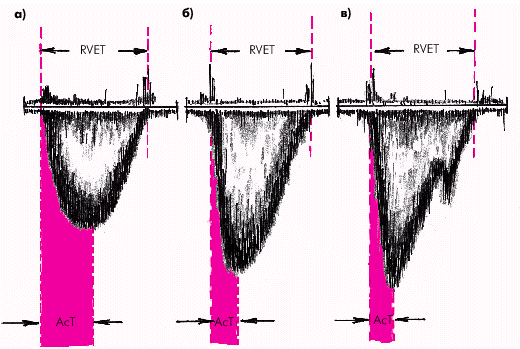
Качественные критерии легочной гипертензии заключаются в изменении формы потока крови в выносящем тракте ПЖ и в устье клапана легочной артерии. При нормальном давлении в легочной артерии форма потока крови приближается к куполообразной и симметричной (рис. 2.35, а), а при легочной гипертензии становится треугольной или двухпиковой. Треугольный тип формы кривой характеризуется более быстрым формированием пика линейной скорости, который смещается к началу кривой (рис. 2.35, б). Двухпиковый тип кривой также отличается уменьшением времени начального ускорения кровотока в легочной артерии, после чего наблюдается мезосистолическое его замедление, а затем снова — позднесистолическое ускорение (рис. 2.35, в). Кривая линейной скорости при этом приобретает своеобразный W-образный вид.
|
| Рис. 2.35. Изменение формы допплерограммы систолического потока крови в выносящем тракте правого желудочка: а — куполообразная и симметричная форма потока при отсутствии легочной гипертензии, б — треугольная форма потока крови при легочной гипертензии, в — двухпиковый тип кривой при легочной гипертензии. Объяснение в тексте |
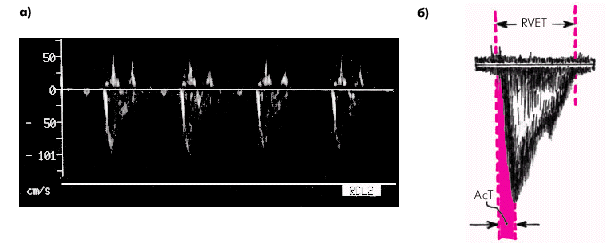
Метод количественного определения среднего давления в легочной артерии (СрДЛА) (по A. Kitabatake с соавт., 1983). Данный метод отличается относительной простотой и в то же время достаточной точностью определения СрДЛА. Он основан на измерении некоторых количественных параметров, характеризующих систолический поток крови в выходном отделе ПЖ (рис. 2.36), и вычислении отношения времени ускорения потока (времени от начала кривой до ее пика — АсТ) к общей длительности изгнания из ПЖ (RVET). Было показано, что это отношение находится в обратной зависимости от величины среднего давления в легочной артерии. В табл. 2.9. представлены значения СрДЛА в зависимости от величины отношения AcT/RVET.
|
| Рис. 2.36. Допплерограмма систолического потока крови в устье легочной артерии у больной с легочной гипертензией (а) и измерение количественных параметров допплерограммы, необходимых для расчета среднего давления в легочной артерии (б). Объяснение в тексте |
Таблица 2.9
Среднее давление в легочной артерии в зависимости от величины отношения
AcT/RVET (по данным импульсной допплер-эхокардиографии)
| AcT/RVET | СрДЛА, мм рт. ст. | AcT/RVET | СрДЛА, мм рт. ст. | AcT/RVET | СрДЛА, мм рт. ст. |
| 0,10 | 131,8 | 0,26 | 47,0 | 0,39 | 20,3 |
| 0,14 | 101,8 | 0,27 | 44,0 | 0,40 | 19,0 |
| 0,15 | 95,4 | 0,28 | 41,3 | 0,41 | 17,8 |
| 0,16 | 89,5 | 0,29 | 38,7 | 0,42 | 16,7 |
| 0,17 | 83,9 | 0,30 | 36,3 | 0,43 | 15,7 |
| 0,18 | 78,7 | 0,31 | 34,0 | 0,44 | 14,7 |
| 0,19 | 73,9 | 0,32 | 31,9 | 0,45 | 13,8 |
| 0,20 | 69,2 | 0,33 | 29,9 | 0,46 | 12,9 |
| 0,21 | 64,8 | 0,34 | 28,5 | 0,47 | 12,1 |
| 0,22 | 60,8 | 0,35 | 26,3 | 0,48 | 11,4 |
| 0,23 | 57,0 | 0,36 | 24,6 | 0,49 | 10,7 |
| 0,24 | 53,4 | 0,37 | 23,1 | 0,50 | 10,0 |
| 0,25 | 50,1 | 0,38 | 21,7 | 0,51 | 9,4 |
Существуют и другие, более точные, способы эхокардиографического определения систолического и диастолического давления в легочной артерии.
| 2.5.6. Ультразвуковая флебография |

|
 Запомните
Ультразвуковыми признаками застоя крови в венозном русле большого круга кровообращения являются: уменьшение коллабирования нижней полой вены во время глубокого вдоха менее чем на 50%; расширение портальных вен (печеночной, воротной, брыжеечной, селезеночной) и уменьшение их опорожнения во время вдоха. Запомните
Ультразвуковыми признаками застоя крови в венозном русле большого круга кровообращения являются: уменьшение коллабирования нижней полой вены во время глубокого вдоха менее чем на 50%; расширение портальных вен (печеночной, воротной, брыжеечной, селезеночной) и уменьшение их опорожнения во время вдоха.
|
| 2.5.7. Дополнительные инструментальные методы исследования |

|
- радионуклидная вентрикулография;
- катетеризация правых отделов сердца плавающим катетером Свана-Ганца с измерением давления в камерах сердца и ЛА, в том числе определение ЦВД и давления “заклинивания” ЛА (ДЗЛА) (см. главу 6);
- нагрузочная сцинтиграфия миокарда с 201Tl для количественной оценки нарушений коронарной перфузии (см. главы 5 и 6);
- коронароангиография (КАГ) для всесторонней оценки состояния коронарного русла.
| 2.6. Лечение хронической систолической сердечной недостаточности |

|
- больные с различными причинами возникновения ХСН;
- больные с явными клиническими симптомами и сниженной систолической функцией ЛЖ (снижением ФВ и СИ по данным эхокардиографического исследования);
- больные с клинической симптоматикой СН, но без признаков систолической дисфункции (диастолическая ХСН);
- больные с бессимптомной дисфункцией ЛЖ (снижение ФВ и СИ без клинических признаков СН) и т.п.
| 2.6.1. Этиологическое лечение |

|
- артериальная гипертензия (нормализация АД);
- бради- и тахиаритмии (коррекция нарушений сердечного ритма и проводимости);
- злоупотребление алкоголем (прекращение приема алкоголя);
- ожирение (снижение массы тела);
- пороки сердца (хирургическая коррекция порока);
- тиреотоксикоз или микседема (адекватная коррекция гормональных нарушений);
- экссудативный или констриктивный перикардит (адекватная терапия или хирургическое лечение);
- ИБС (адекватно подобранная антиангинальная терапия или внутрикоронарная ангиопластика и аортокоронарное шунтирование);
- анемии (восстановление содержания эритроцитов и гемоглобина);
- хронические обструктивные заболевания легких (противовоспалительная терапия, лечение обструктивного синдрома).
| 2.6.2. Устранение факторов, провоцирующих ухудшение состояния больных ХСН |

|
- несоблюдение врачебных рекомендаций (избыточное потребление соли, жидкости, нарушение схемы приема лекарственных средств и др.);
- нарушение индивидуального режима физической активности;
- инфекции;
- употребление алкоголя;
- острый ИМ, нестабильная стенокардия;
- ТЭЛА;
- преходящие расстройства электролитного обмена (гипокалиемия, гипофосфатемия, гипокальциемия и др.);
- беременность и роды;
- возникновение пароксизмов или постоянной формы мерцательной аритмии;
- дисфункция щитовидной железы.
| 2.6.3. Немедикаментозное лечение |

|
 Запомните
При отсутствии признаков обострения заболевания, в частности прогрессирующей левожелудочковой недостаточности или нарастающего отечного синдрома, неоправданно длительное и резкое ограничение физической активности, строгий постельный или полупостельный режим у большинства больных ХСН быстро приводят к развитию синдрома детренированности, значительным структурным изменениям скелетных мышц и прогрессирующему снижению толерантности к нагрузкам. Запомните
При отсутствии признаков обострения заболевания, в частности прогрессирующей левожелудочковой недостаточности или нарастающего отечного синдрома, неоправданно длительное и резкое ограничение физической активности, строгий постельный или полупостельный режим у большинства больных ХСН быстро приводят к развитию синдрома детренированности, значительным структурным изменениям скелетных мышц и прогрессирующему снижению толерантности к нагрузкам.
|
Физическая реабилитация пациентов с ХСН должна учитывать степень функциональных нарушений. Наиболее эффективны физические тренировки, организуемые для больных ХСН в специальных кардиологических и реабилитационных центрах, которые осуществляются под постоянным врачебным контролем за гемодинамикой и другими показателями. Однако более доступны самостоятельные физические упражнения, объем и интенсивность которых индивидуально определяются лечащим врачом.
У больных с ФК IV по NYHA, которые при проведении 6-минутного теста-ходьбы могут пройти в умеренном темпе не более 150 м (см. выше), показаны регулярные дыхательные упражнения или физические упражнения в положении сидя. Например, больным можно рекомендовать редкое, медленное и глубокое дыхание с пролонгированным вдохом или выдохом (4–5 дыхательных циклов за 1 мин).
У больных ФК III (дистанция 6-минутной ходьбы до 300 м), находящихся в стабильном состоянии, наиболее простым и доступным методом физической тренировки является дозированная ходьба. В течение первых 5 недель рекомендуется ежедневно проходить 1 км за 13–15 мин (всего около 8–10 км в неделю). В зависимости от индивидуальной переносимости, начиная с 6-й недели, увеличивают расстояние, пройденное за неделю до 10–20 км; при этом скорость ходьбы увеличивается до 11 мин на 1 км.
Больным ФК I–II по NYHA (дистанция 6-минутной ходьбы, соответственно, до 500 м и 400 м) рекомендуют сочетание нескольких видов нагрузки, например ходьбы и плавания.
В зависимости от функционального состояния больных и индивидуальной тренированности величина и мощность дозируемой физической нагрузки могут быть пересмотрены.
 Запомните
Основными условиями для проведения физической реабилитации больных ХСН являются: стабильное состояние больных и отсутствие признаков обострения основного заболевания (например, ИБС); отсутствие признаков обострения СН, в частности прогрессирующей левожелудочковой недостаточности или выраженного отечного синдрома; неукоснительное выполнение больным рекомендаций по приему ЛС; периодический контроль за основными гемодинамическими показателями и ЭКГ; выполнение больными ХСН физических упражнений не должно сопровождаться ухудшением самочувствия больного и ощущением большего, чем обычно, утомления. Запомните
Основными условиями для проведения физической реабилитации больных ХСН являются: стабильное состояние больных и отсутствие признаков обострения основного заболевания (например, ИБС); отсутствие признаков обострения СН, в частности прогрессирующей левожелудочковой недостаточности или выраженного отечного синдрома; неукоснительное выполнение больным рекомендаций по приему ЛС; периодический контроль за основными гемодинамическими показателями и ЭКГ; выполнение больными ХСН физических упражнений не должно сопровождаться ухудшением самочувствия больного и ощущением большего, чем обычно, утомления.
|
Диета больных ХСН должна быть калорийной, легкоусвояемой и скорректированной в отношении суточного приема соли и жидкости. Целесообразно дробное питание 5–6 раз в сутки.
Общая калорийность питания рассчитывается с учетом массы тела (МТ) и ФК больных ХСН. Для характеристики МТ в настоящее время используют расчет так называемого индекса массы тела (ИМТ) по формуле:
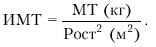
|
В табл. 2.10. приведены значения ИМТ у пациентов с избыточным весом, ожирением и дефицитом МТ.
Таблица 2.10
Характеристика массы тела в зависимости от величины ИМТ
| Масса тела | ИМТ, кг/м2 |
| Нормальная | 20–25 |
| Избыточная | 26–29 |
| Ожирение | і 30 |
| Дефицит МТ | < 20 |
Обычно для больных ХСН с нормальной МТ (ИМТ — 20–25), ведущих малоподвижный образ жизни или выполняющих легкую физическую нагрузку, общая калорийность суточного рациона составляет 1900–2500 ккал. Если у больных имеется избыточная МТ или ожирение, следует предусмотреть уменьшение пищевого рациона на 20–30%, в частности за счет содержания в пище животных жиров. Наоборот, при дефиците МТ (ИМТ меньше 20) у больных с сердечной кахексией суточная калорийность диеты должна быть на 20–30% больше.
Из рациона питания больных ХСН целесообразно исключить шоколад, крепкий чай и кофе, острые блюда, копчености, продукты, богатые холестерином (животный жир, икра, мозги и т.п.), мучные изделия, жирные сорта мяса, сало и т.п. Резко ограничивают или исключают прием алкоголя и запрещают курение.
Потребление поваренной соли обычно ограничивают до 5–6 г в сутки. Более значительное ограничение в пище натрия хлорида (до 1,5–3,0 г в сутки) показано в периоды дестабилизации состояния больных, при быстром прогрессировании симптомов левожелудочковой недостаточности или отечного синдрома. В этих случаях больным предлагается не подсаливать пищу и не употреблять продукты, содержащие повышенное количество NаCl (соленые огурцы, рыба, копчености). Даже такое ограничение обычно обеспечивает потребление соли не более 3,0 г в сутки. Если необходимо еще больше ограничить поступление NаСl (до 1,0–1,5 г в сутки), например, при выраженном отечном синдроме, пациентам ХСН дополнительно рекомендуют приготовление пищи без соли.
Ограничение потребляемой жидкости должно быть достаточно разумным. При любой стадии ХСН не следует уменьшать количество вводимой жидкости меньше 0,8 л. Обычно оно составляет 1,2–1,5 л в сутки, включая все жидкие блюда (супы, чай, соки и т.п.). Даже на фоне отечного синдрома резкое ограничение вводимой жидкости в ряде случаев может сопровождаться повышением осмолярности плазмы, что приводит к избыточной продукции антидиуретического гормона (АДГ) и способствует еще большей задержке жидкости в организме и усилению отеков. В этих случаях ограничение приема натрия хлорида оказывается более эффективным, чем уменьшение количества вводимой жидкости.
Больным ХСН рекомендуют употреблять в пищу продукты, содержащие калий (курагу, изюм, печеный картофель, орехи, брюссельскую капусту, бананы, персики, гречневую и овсяную крупу, телятину и др.). Калиевая диета особенно показана при лечении мочегонными средствами и сердечными гликозидами.
| .6.4. Медикаментозное лечение |

|
 Запомните
Современная концепция медикаментозного лечения больных ХСН основана на двух главных принципах. 1. Использование ЛС с положительным инотропным действием на сердце (в случае систолической ХСН). 2. Всесторонняя разгрузка сердечной деятельности, которая включает: снижение преднагрузки (уменьшение ОЦК, притока крови к сердцу и т.п.); снижение постнагрузки (уменьшение ОПСС); снижение активности нейрогуморальных систем организма (САС, РААС и др.) (“нейрогуморальная разгрузка”); миокардиальная разгрузка (снижение работы сердца и потребности миокарда в кислороде). Запомните
Современная концепция медикаментозного лечения больных ХСН основана на двух главных принципах. 1. Использование ЛС с положительным инотропным действием на сердце (в случае систолической ХСН). 2. Всесторонняя разгрузка сердечной деятельности, которая включает: снижение преднагрузки (уменьшение ОЦК, притока крови к сердцу и т.п.); снижение постнагрузки (уменьшение ОПСС); снижение активности нейрогуморальных систем организма (САС, РААС и др.) (“нейрогуморальная разгрузка”); миокардиальная разгрузка (снижение работы сердца и потребности миокарда в кислороде).
|
В соответствии с этой концепцией все ЛС, применяемые при ХСН, можно разделить на 3 группы.
1.
Основные (базисные) ЛС, эффективность и безопасность применения которых у больных ХСН хорошо доказана и не вызывает сомнений. К их числу относят 4 класса препаратов:
- ингибиторы АПФ;
- диуретики;
- сердечные гликозиды;
- b-адреноблокаторы.
2.
Дополнительные ЛС, эффективность которых также достаточно высока, но требуют уточнения некоторые вопросы показаний и противопоказаний, а также влияния этих препаратов на отдаленный прогноз больных ХСН. К дополнительным ЛС относятся:
- антагонисты рецепторов ангиотензина II (лозартан и др.);
- антагонисты рецепторов альдостерона (альдактон и др.);
- блокаторы медленных кальциевых каналов;
- амиодарон (кордарон) и др.
3.
Вспомогательные ЛС,применение которых необходимо в определенных конкретных клинических ситуациях:
- периферические вазодилататоры (ИБС, АГ);
- антиаритмические ЛС (при наджелудочковых и желудочковых аритмиях);
- ацетилсалициловая кислота (например, у больных, перенесших ИМ);
- непрямые антикоагулянты (при выраженной дилатации сердца, внутрисердечных тромбах, мерцательной аритмии);
- статины (при гиперлипидемиях, атеросклерозе).
Рассмотрим применение у больных ХСН базисных и некоторых вспомогательных (дополнительных) лекарственных препаратов.
Ингибиторы АПФ
По современным представлениям, ингибиторы АПФ являются “золотым стандартом” терапии больных ХСН (T. Cohn, 1988, E. Braunwald, 1991). В последние годы были получены убедительные доказательства способности ингибиторов АПФ замедлять прогрессирование ХСН, снижать летальность, улучшать прогноз и качество жизни больных ХСН.
Механизм действия
Механизм действия ЛС, относящихся к классу ингибиторов АПФ, связан с их способностью блокировать эффекты ключевого фермента РААС, “запускающего” целый каскад изменений в органах и тканях, которые закономерно приводят к развитию и прогрессированию СН (см. выше). При этом речь идет о действии ингибиторов АПФ как на ренально-надпочечниковую (гуморальную) РААС, так и на тканевые РАС (рис. 2.37). Последнее обстоятельство имеет особенно важное значение, поскольку активация именно тканевых нейрогормонов лежит в основе ремоделирования сердца и формирования систолической и диастолической дисфункции миокарда.
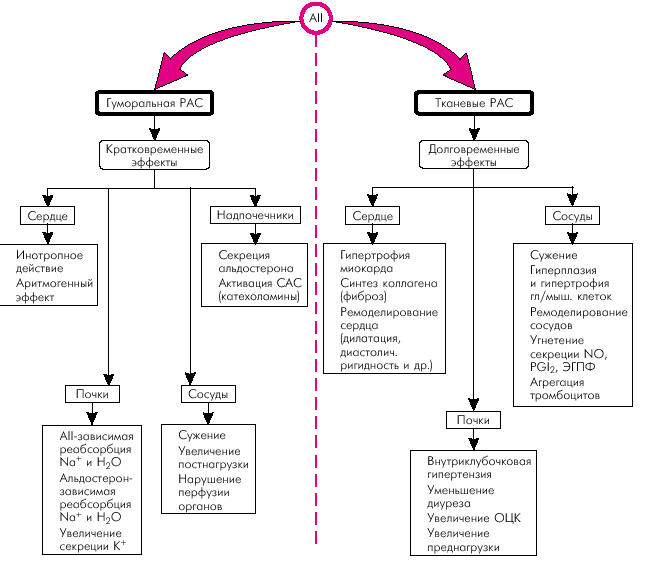
|
| Рис. 2.37. Основные эффекты гуморальной (почечной) и тканевых ренин-ангиотензиновых систем (РАС) при ХСН |
Напомним, что повышение в миокарде содержания тканевого АII сопровождается вазоконстрикцией коронарных сосудов, развитием гипертрофии миокарда, быстрым прогрессированием интерстициального фиброза, нарушением кальциевого обмена в кардиомиоцитах, что приводит к развитию диастолической ригидности миокарда и повышает риск развития аритмий.
Кроме того, активация тканевых РАС в сосудистой стенке различных органов ведет к пролиферации гладкомышечных клеток, гипертрофии и утолщению стенки сосудов, а также уменьшает высвобождение эндотелиальных факторов релаксации. Повышается также агрегация тромбоцитов и риск тромбообразования, что еще больше усугубляет нарушения перфузии жизненно важных органов (сердце, головной мозг, почки).
 Запомните
Эффективность ингибиторов АПФ при ХСН связана, прежде всего, с устранением активации тканевых РАС и выражается в следующих положительных реакциях (Б.А. Сидоренко, Д.В. Преображенский, 1995): замедление процессов ремоделирования сердца, сосудов и других органов; обратное развитие гипертрофии миокарда; предотвращение прогрессирования дилатации ЛЖ; замедление формирования интерстициального фиброза миокарда; снижение диастолической ригидности ЛЖ; коронарная вазодилатация; улучшение регионарного кровообращения в почках, головном мозге, скелетных мышцах и других органах; уменьшение риска возникновения аритмий. Запомните
Эффективность ингибиторов АПФ при ХСН связана, прежде всего, с устранением активации тканевых РАС и выражается в следующих положительных реакциях (Б.А. Сидоренко, Д.В. Преображенский, 1995): замедление процессов ремоделирования сердца, сосудов и других органов; обратное развитие гипертрофии миокарда; предотвращение прогрессирования дилатации ЛЖ; замедление формирования интерстициального фиброза миокарда; снижение диастолической ригидности ЛЖ; коронарная вазодилатация; улучшение регионарного кровообращения в почках, головном мозге, скелетных мышцах и других органах; уменьшение риска возникновения аритмий.
|
Кроме того, воздействие ингибиторов АПФ на гуморальную (эндокринную) РААС и уменьшение образования циркулирующегоАII также имеют несколько важных следствий.
Дата добавления: 2015-08-04; просмотров: 1196;
Генерация страницы за: 0.018 сек.
