Виды коагуляции электролитами
При коагуляции золя электролитами различают концентрационную коагуляцию и нейтрализационную коагуляцию.
Концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения дзета-потенциала.
Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия.
Формула мицеллы имеет вид:
{n[AgCl] • mAg+ ■ (т - x)NO-3}x+ • xNO-3.
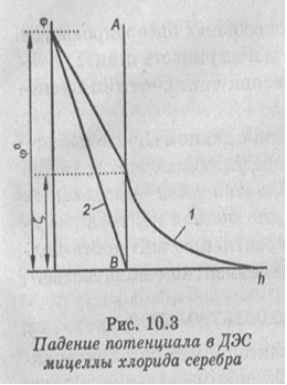
На рис. 10.3 показан график изменения потенциала в ДЭС мицеллы хлорида серебра. Кривая 1 относится к исходной мицелле, кривая 2 — после добавления KN03 в количестве, вызывающем коагуляцию. При добавлении KN03 диффузный слой противоионов сжимается, формула мицеллы приобретает вид:
{n[AgCl] • mAg+ ■ mNO-3}.
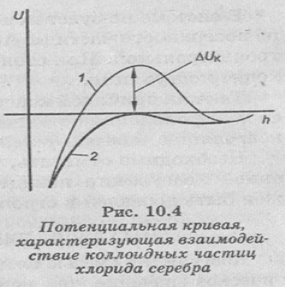
На рис. 10.4 представлены потенциальные кривые, характеризующие взаимодействие частиц в этом золе. Дзета-потенциал исходной коллоидной частицы положительный, это создает потенциальный барьер коагуляции ΔUK > 0 (кривая 1). Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит. После добавления нитрата калия дзета-потенциал становится равным нулю и ΔUk — 0 (кривая 2). Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения — происходит коагуляция. Так как в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией.
Нейтрализационная коагуляция происходит при добавлении к золю неиндифферентного электролита. Как отмечалось в разделе 8.4, при этом потенциалопределяю-щие ионы связываются в малорастворимое соединение, что приводит к уменьшению абсолютных величин термодинамического потенциала, а следовательно, и дзета-потенциала вплоть до нуля.
Если взять в качестве исходного только что рассмотренный золь хлорида серебра, то для нейтрализации потенци-алопределяющих ионов Ag+ в золь необходимо ввести, например, хлорид калия. После добавления определенного количества этого неиндифферентного электролита мицелла будет иметь вид:
{(п + m)AgCl}.
В системе не будет ионов, способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной. При столкновении таких частиц происходит коагуляция.
Так как причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией.
Необходимо отметить, что для полной нейтрализационной коагуляции неиндифферентный электролит должен быть добавлен в строго эквивалентном количестве.
Дата добавления: 2015-08-04; просмотров: 4125;
