Уравнение адсорбции Гиббса.
Рассмотрим адсорбцию на границе раствор – газ. Если раствор спирта в воде, то сначала концентрация во всем объеме будет одинаковая. Со временем концентрация спирта на поверхности возрастает. Спирт, как менее полярный, будет концентрироваться на поверхности. Получается, что на поверхности идет концентрирование одного из веществ.
Сs ≠ Сα , т.е. концентрация веществ в объеме и на поверхности не равны.
Это явление предсказал Гиббс. Позже это было подтверждено экспериментами.
Запишем для поверхностного слоя:
dUs = TdSs + σds + ∑μidnsi 5.2.1.
Проинтегрируем это выражение:
Us= TSs + σs + μi 5.2.2.
dU s = TdSs + Ss dT + σds + sdσ + ∑μidnsi + ∑nsi dμi5.2.3.
Вычтем из уравнения 5.2.1. уравнение 5.2.3.
SsdT + sdσ + ∑nsi dμi = 0 5.2.4.
При Т=const -sdσ = ∑nsi dμi (5.2.5.)
Разделим на S: dσ = - 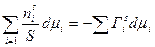 (5.2.6.)
(5.2.6.)
Применим (5.2.6.) для бинарной системы: 1-растворитель, 2-растворенное вещество.
dS = - 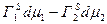 (5.2.7.)
(5.2.7.)
Выражение (5.2.7.) содержит два неизвестных Г1 и Г2 , поэтому не дает однозначного решения. Гиббс предложил наложить на систему следующие условия: провести разделяющую поверхность так, чтобы Г1 = 0.
dσ = - Г2 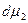 (5.2.8.)
(5.2.8.)
В этом случае физический смысл Г2 можно определить как избыток количества второго компонента в объеме, включающем единицу поверхности, по сравнению с его количеством в объеме, содержащем то же число молей растворителя.
Выразим химический потенциал:
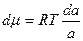 или
или 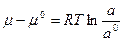 (5.2.9.)
(5.2.9.)
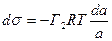 (5.2.10.)
(5.2.10.)
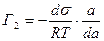 (5.2.11.)
(5.2.11.)
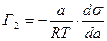 (5.2.12.)
(5.2.12.)
Для разбавленного раствора:
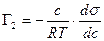 (5.2.13.)
(5.2.13.)
Уравнения (5.2.12) и (5.2.13) называют уравнениями адсорбции Гиббса..
с- концентрация 2-го компонента в объеме фазы; а- активность.
В зависимости от знака производной 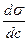 вещества делят на поверхностно-активные ( вещества, снижающие при растворении поверхностное натяжение растворителя.
вещества делят на поверхностно-активные ( вещества, снижающие при растворении поверхностное натяжение растворителя. 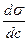 < 0 , Г2<0 (концентрируется на поверхности). Большинство органических кислот и их соли, эфиры, спирты, амины, аминокислоты, белки и др.) и поверхностно-инактивные (повышают σ растворителя
< 0 , Г2<0 (концентрируется на поверхности). Большинство органических кислот и их соли, эфиры, спирты, амины, аминокислоты, белки и др.) и поверхностно-инактивные (повышают σ растворителя 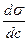 > 0 , Г < 0. Эти вещества будут удаляться из поверхностного слоя. Почти все водные растворы электролитов, кислоты, щелочи, соли.)
> 0 , Г < 0. Эти вещества будут удаляться из поверхностного слоя. Почти все водные растворы электролитов, кислоты, щелочи, соли.)
Дата добавления: 2015-08-04; просмотров: 1341;
