Мурексидная проба
Реакция основана на окислительно-гидролитическом " разложении веществ группы ксантина до производных пиримидина, в которых 1 или 2 аминогруппы конденсируются друг с другом до образования пурпурной кислоты, имеющей в виде аммонийной соли красно-фиолетовое окрашивание. Для проведения реакции препарат нагревают на водяной бане до полного упаривания с окислителем (ЬЬСЪ. В и, НЫОз) в кислой среде. Затем добавляют раствор аммиака; появляется пурпурно-красное окрашивание.
Химизм (на примере мочевой кислоты):
-14'
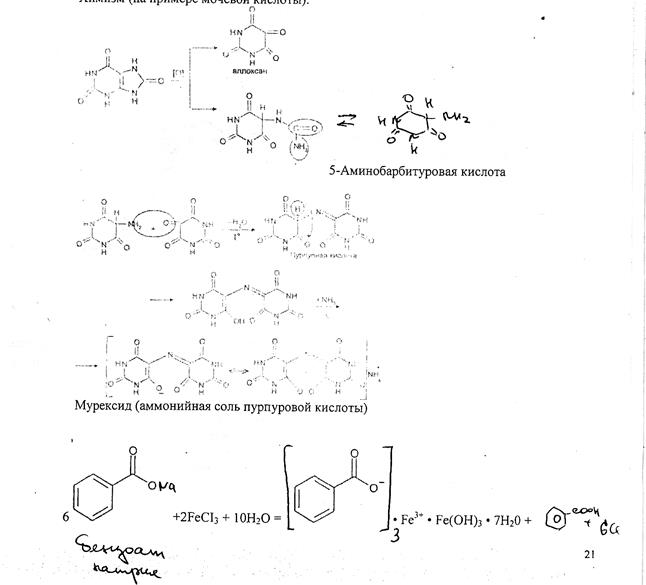
5-Аминобарбитуровая кислота
>'■•*•'■ \ Н
'! "' Чк/' '- /• ■•?-■■' '■•<•- О '
Мурексид (аммонийная соль пурпуровой кислоты)
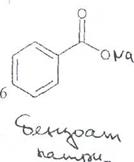
+2FeCb + 10H-.O
Fe3+ • Fe(OH)3 •7Н20 +
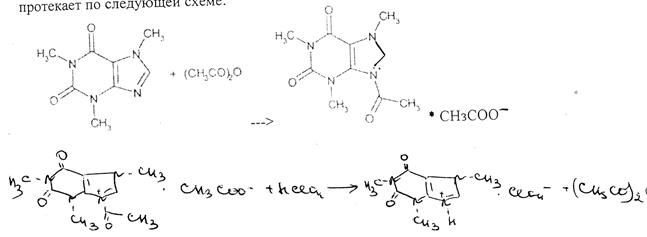
^Количественное определение. 1. Кислотно-осноное титрование в неводной среде при определении кофеина в субстанциях. Кофеин в водных растворах проявляет очень слабые основные свойства, практически его растворы имеют нейтральную реакцию. С минеральными кислотами кофеин солей не образует (они сразу же гидролизуются). Поэтому метод нейтрализации в водных растворах для кофеина неприменим. В неводной среде (хлороформ, уксусный ангидрид, бензол) кофеин проявляет выраженные основные свойства и его можно оттитровать хлорной кислотой (индикатор кристаллический фиолетовый).
Процесс титрования кофеина в неводной среде (смесь хлороформа и уксусного ангидрида) протекает по следующей схеме:
Кислотно основное титрование в водной среде. Используют для определения кофеина-бензоата натрия в микстуре. Кофеин-бензоат натрия определяют по остатку бензоата натрия титрованием стандартным раствором хлороводородной кислоты в присутствии эфира и смешанного индикатора (растворы метилового оранжевого и метиленового синего в соотношении 1:1):
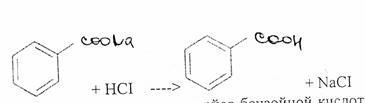
Для извлечения выделяющейся бензойной кислоты определение проводят в присутствии эфира. Кофеин-бензоат натрия должен содержать 38-40% кофеина и 58-62% бензоата натрия.
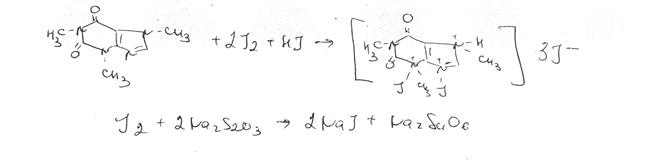
Йодометрия. Применяется для определения кофеина в кофеин-бензоате натрия. Метод основан на образовании осадка перйодида кофеина в кислой среде (coff ■ HI * I.). который отфильтровывают и в фильтрате определяют избыток йода. Иодометрическое определение используют (ФС) для количественного определения кофеина в кофеине-бёнзоате натрия. Титрантом служит 0,1 М раствор иода. Периодид кофеина осаждают, осадок отделяют, пропуская смесь через вату в сухую колбу. В аликвотной части фильтрата определяют избыток титранта с помощью 0,3 М раствора тиосульфата натрия (индикатор крахмал). Параллельно проводят контрольный опыт.о >
Кофеин-бензоат натрия хранят в сухом, защищенном от света месте при температуре не выше +25°С. Список Б.
Sodium Bromide (Natrii bromidum) — натрия бромид NaBr
Белый кристаллический порошок без запаха, соленого вкуса. Гигроскопичен. Растворим в воде, этаноле и глицерине.
Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и по образованию зеленовато-желтого кристаллического осадка с цинкуранилацетатом (октаацетат-триуранилатом цинка) в уксуснокислой среде:
NaBr + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9Н2О -> NaZn[(UO2)3(CH3COO)9] * 9Н2О + НВг
Реакции идентификации бромидов
NaBr + AgNO3 -> AgBr + NaNO3 осадок желт.цв.
AgBr + 2NH3 *H2O ->[Ag(NH3)2]Br + 2H2O
Бромиды обнаруживают также с помощью реакций окисления галогенидов до свободных галогеновТ~~~используя различные окислители. Образующиеся галогены извлекают хлороформом и наблюдают окраску хлороформного слоя. Для обнаружения бромид-иона в качестве окислителя используют хлорамин в присутствии хлороводородной кислоты:
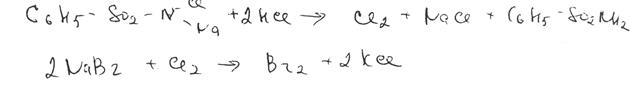 Слой хлороформа окрашивается в желто-бурый цвет.
Слой хлороформа окрашивается в желто-бурый цвет.
Количественное определение галогенидов выполняют аргентометрическим методом. Лекарственные препараты бромидов титруют в нейтральной среде, в качестве индикатора используют хромат калия (метод Мора). Реакции протекают по схеме:
NaBr + AgNO3 -> AgBr + NaNO3
Избыток титранта (первая капля) взаимодействует с индикатором с образованием осадка оранжево-красного цвета, по которому устанавливают конечную точку титрования:
2AgNO3 + К2СЮ4 -> Ag2Cr04 + 2K.NO3
Для количественного определения галогенидов можно использовать метод ионообменной хроматографии, с последующим алкалиметрическим завершением.
Бромиды хранят в сухом месте в плотно укупоренных банках., кроме того, предохраняют от действия света (в склянках оранжевого цвета).
Magnesium Sulfate (Magnesii sulfas) — магния сульфат MgSCM 7H2OБесцветные призматические выветривающиеся кристаллы Магния сульфат растворим в воде, практически нерастворим в этаноле.
Для обнаружения иона магния используют общую реакцию образования нерастворимого воде, но растворимого в уксусной кислоте белого кристаллического осадка фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли магния гидрофосфата динатрия и раствора аммиака:
NH4CI
MgCI2 + Na2HPO4 + NH3. H2O------->• NH4MgP04i+ 2NaCI + H2O
NH4MgPO4 + 2CH3COOH -> Mg(CH3COO)2 + NH4H2PO4
К реакционной смеси необходимо прибавлять раствор хлорида аммония (до рН 9) во избежание образования в щелочной среде аморфного осадка гидроксида магния Mg(OH)2 (при рН > 10). Однако большой избыток хлорида аммония может препятствовать осаждению фосфата магния-аммония.
В магния сульфате устанавливают наличие сульфат-иона:
MgSO4 + ВаСЬ -> BaSO4(+ MgCI2
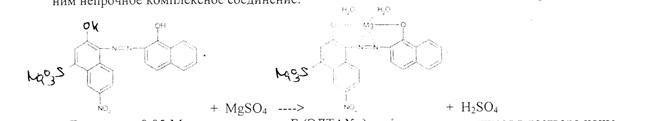
Соединения магния количественно определяют прямым комплексонометрическим методом с использованием индикатора кислотного хром черного специального {эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с
ним непрочное комплексное соединение:
 -
-
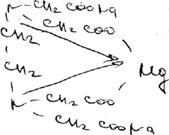
Титрант -— 0,05 М раствор трилона Б (ЭДТА№2) связывает находящиеся в растворе ионы магния в комплексное соединение:
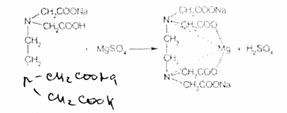
Поскольку при этом происходит выделение серной кислоты, для поддержания оптимального значения рН среды необходимо прибавлять аммиачный буферный раствор.
В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл — ЭДТА Na2, титрант вступает во взаимодействие с ионами магния, содержащимися в составе комплекса металл — индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение ЭДТА Na2 — металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая (окраска раствора переходит в синюю окраску свободного индикатора:
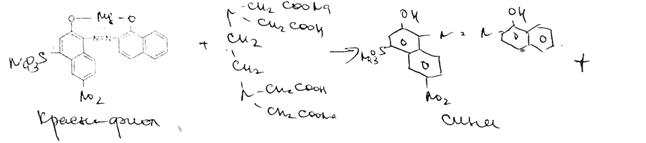
Соединения магния хранят в хорошо укупоренной таре, так как магния сульфат в плохо укупоренной таре постепенно теряет кристаллизационную воду.
Вопрос 4. Рецепт должен быть выписан на бланке ф.№107/У. заверенным личной печатью и подписью врача. Проверка доз:
Кофеин-бензоат натрия список Б ВРД- 0,5/2-0,25 РД= 0,4:33- 0,01
ВСД- 1,5/2-0,75 СД=0,03
Количество приемов: 200:6 = 33
Дозы не завышены. НЕО не регламентированы.
Отпуск отдельных ЛС производится в количествах, не превышающих предельно допустимых норм на один рецепт. Поэтому на следующем этапе аптечный работник проверяет, соответствует ли количество выписанных Л С установленным приказами Минздрава России от 23.08.99 № 328 и от 09.01.2001 № 3 предельно допустимым для выписывания нормам.
В некоторых случаях регламентом предусмотрено превышение установленных норм. Например, в глазных каплях и мазях этилморфина гидрохлорид (дионин) может выписываться в количествах до 1 г при наличии указания врача на рецепте «По специальному назначению», заверенного подписью и личной печатью врача, печатью «Для рецептов».
Для инкурабельных онкологических и гематологических больных количество выписываемых в одном рецепте следующих наркотических средств (бупренорфин. дигидрокодеин ретард, дипидолор, морфина сульфат и морфина гидрохлорид, омнопон. промедол, просидол) может быть увеличено в два раза против установленных норм. При выписывании остальных наркотических ЛС их предельно допустимое количество для выписывания в одном рецепте может в пять раз превышать разовую дозу, указанную в Инструкции по применению ЛС.
Нормы выписывания и отпуска сильнодействующих ЛС и производных барбитуровой кислоты для инкурабельных онкологических и гематологических больных могут быть увеличены в два раза против установленных норм.
Для этилового спирта установлены следующие нормы отпуска:
в чистом виде — до 50 г по рецептам с надписью «Для наложения компрессов» (с указанием необходимого разведения) или «Для обработки кожи»: в смеси с другими ингредиентами при индивидуальном изготовлении лекарств — не более 50 г;
больным с хроническим течением болезни — до 100 г по рецептам с надписью «По специальному назначению», отдельно скрепленной подписью врача и печатью ЛПУ «Для рецептов». Остальные ЛС отпускаются из аптек в количествах, указанных в рецепте.
Таблица 1 Предельно допустимые нормы отпуска ЛС на один рецепт
| Наименование ЛС | Форма выпуска и дозировка | Количество | |||
| Метилтестостер | Таблетки по 5 мг | 1————— 1 упаковка | |||
| он | |||||
| Тестостерон | Раствор для инъекций в | 1 упаковка | |||
| оливковом масле 1 %-й и | |||||
| 5%-й, 1 мл — ампулы | |||||
| Капсулы по 40 мг — | |||||
| флаконы | |||||
| Бупренорфин | Таблетки для | 50 таблеток | |||
| сублингваль-ного приема | 30 ампул 15 | ||||
| по 0,2 мг Раствор для | ампул | ||||
| инъекций: ампулы 0,3 мг | |||||
| в 1 мл ампулы 0,6 мг в 2 | |||||
| мл | |||||
| Этилморфина | Таблетки по 10 и 15 мг | 0,2 г | |||
| гидрохлорид | |||||
| (дионин) | |||||
| Кодеин | Капли для приема | 0,2 г | |||
| внутрь: 2,17 мг/100 г — | |||||
| флаконы по 20 и 50 г; | |||||
| сироп 5 мг/5 мл — | |||||
| флаконы по 100 мл | |||||
| Пахикарпина | Таблетки 0,1 г; 3%~й | 1,2 г | |||
| гидроиодид | раствор для инъекций | ||||
| Морфина | Раствор для инъекций: | 20 ампул | |||
| гидрохлорид | ампулы 10 мг в 1 мл | ||||
| Омнопон | Раствор для инъекций: | ] 0 ампул 5 ампул | |||
| 1 %-й, ампулы по 1 мл | |||||
| 2%-й, ампулы по 1 мл | |||||
| Промедол | Таблетки для приема | 50 таблеток | |||
| (тримеперидина | внутрь по 25 мг Раствор | 10 ампул 10 | |||
| гидрохлорид) | для инъекций: 1—2%-й. | шприц-тюбиков | |||
| ампулы по 1 мл 1—2%-й, | |||||
| шприц-тюбики по 1 мл | |||||
| Эфедрина | Таблетки для детей по 2, | 0,6 г | |||
| гидрохлорид | 3 и 10 мг. 10 шт. в | ||||
| упаковке таблетки по 25 | |||||
| мг Раствор для инъекций | |||||
| 5%-й, ампулы по 1 мл | |||||
| Капли назальные 2%-й | |||||
| Производные | раствор, 10 мл во | ||||
| барбитуровой | флаконе | ||||
| кислоты, | 10—12 таблеток | ||||
| например | Таблетки по 50 и 100 мг, | ||||
| фенобарбитал | 6 шт.; таблетки для детей | ||||
| - | по 5 мг, 6 шт. | ||||
Рецепт, не отвечающий хотя бы одному из требования или содержащий несовместимые лекарственные вещества, считается недействительным. В случае возможности уточнения у врача или другого медицинского работника, выписавшего рецепт, названия ЛП, его дозировки, совместимости и т. п. работник аптечной организации может отпустить ЛС пациенту.
Все неправильно выписанные рецепты остаются в аптеке, погашаются штампом «Рецепт недействителен» ирегистрируются в специальном журнале. Информация о них передается руководителю соответствующего ЛПУ для принятия мер дисциплинарного воздействия к работникам, нарушающим правила выписывания рецептов.
Лечащий врач, в том числе частнопрактикующий, специалист со средним медицинским образованием несет ответственность в соответствии с законодательством РФ за необоснованно и/или неправильно выписанный рецепт.
Таксировка рецептов.Рецепт, выписанный правильно, таксируется, т. е. определяется его розничная цена. В аптеках с оборудованным АРМ этот процесс происходит с помощью различного программного обеспечения (на компьютерах). Розничная цена на экстемпоральные лекарственные формы и внутри аптечную заготовку складывается:
из стоимости исходных ингредиентов;
стоимости аптечной посуды; тарифа за изготовление лекарства.
Аптекам — юридическим лицам предоставлено право самостоятельно разрабатывать тарифы за изготовление и расфасовку ЛС.
Тарифы должны быть утверждены приказом по аптеке. В основу тарификации положены:
нормативы затрат времени на отдельные операции по изготовлению, контролю, фасовке и отпуску экстемпоральных лекарственных форм и внутриаптечной заготовки (разработаны ВНИИФ);
стоимость 1 мин рабочего времени, рассчитанная с учетом средней заработной платы.
К сумме ингредиентов (0,54 + 1,25 + 4,18 + 1.2) прибавляем стоимость склянки (3,68) и тариф за изготовление жидких лекарственных форм: 10,0 за 3 ингредиента и за каждый последующий ингредиент (0,7 х 1 = = 0,7).
Итого стоимость лекарственной формы: 0,54 + 1.25 + 4.18 + 1.2 + 3,68 + + 10.0 + 0.7 = 21.05 (р.).
Регистрация рецептов.Для рецептов, требующих индивидуального изготовления, регистрация может осуществляться различными способами. Наиболее распространенной является квитанционная форма регистрации рецептов. Квитанция заполняется в одном экземпляре при приеме рецептов. Условно в ней можно выделить три части. Первая часть (корешок) квитанции с указанием номера лекарства, Ф.И.О. больного, стоимости и ЛФ остается в аптеке. Корешок квитанции служит основанием для учета ЛС, изготовленных по рецептам. По корешкам в конце смены подсчитывают количество принятых рецептов и общую стоимость отпущенных по ним лекарств. В целях учета корешки комплектуются по 50 и 100 шт. и хранятся в аптеке.
Вторая часть квитанции с указанием номера лекарства, вида ЛФ. фамилии больного, даты и времени изготовления лекарства, его стоимости выдается на руки заказчику.
Третья часть квитанции содержит два одинаковых номера: первый с указанием «приготовил», «проверил», «отпустил» наклеивается на рецепт, второй -— на упаковку отпускаемого лекарства. По этим номерам изготовленные лекарства располагаются на вертушках на рабочем месте провизора по отпуску лекарств. Отпуск изготовленного аптекой лекарства производится по квитанции, номер которой должен совпадать с номером, наклеенным на упаковку лекарства и на оборотную сторону рецепта.
Срок действия рецепта - 2 мес. Рецепт отдается больному с указание на обороте количества отпущенного препарата и даты отпуска и не хранится в аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не действителен».
Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности, а для ЛС. взаимодействующих с пищей, времени их употребления относительно приема пищи (до, во время, после еды).
Микстура хранится в аптеке при Т не выше 25С в течение 10 сут.
Лекарственное растительное сырье хранят в сухом, хорошо вентилируемом помещении в хорошо закрытой таре.
Резаное сырье должно находиться в тканевых мешках, порошки - в двойных мешках (многослойный бумажный — внутренний, тканевый — наружный), в картонных упаковках. Иногда допускается упаковка из полимерных материалов.
Растительное лекарственное сырье периодически контролируют согласно требованиям Государственной фармакологии.
Если сырье поражается плесенью, вредителями или теряет нормальную окраску и запах, его или бракуют, или (после переработки) используют.
Билет,№3
Вопрос 1. Приемку лек. сырья производят партиями.
Партией считают кол-во сырья массой не менее 50 кг одного наименования, однородного по всем показателям и оформленного одним документом, удостоверяющим его качество. Документ должен содержать следующие данные:
— номер и дату выдачи документа;
— наименование и адрес отправителя;
— наименование сырья:
— номер партии:
— массу партии;
— год и месяц сбора или заготовки;
— район заготовки (для сырья от дикорастущих растений) ;
— результаты испытаний качества сырья:
— обозначение нормативно-технической документации на сырье;
— подпись лица, ответственного за качество сырья, с указанием фамилии и должности. Каждую единицу продукции подвергают внешнему осмотру для установления
соответствия упаковки и маркировки требованиям нормативно-технической документации. Обращают внимание на правильность упаковки, состояние тары (отсутствие подмочки, подтеков и других повреждений, отрицательно влияющих на качество и сохранность сырья).
Для проверки соответствия качества сырья требованиям нормативно-технической документации отбирают выборку из неповрежденных единиц продукции, взятых из разных мест партии в количестве, указанном в табл. 1. Проверку качества сырья в поврежденных единицах продукции производят отдельно от неповрежденных, вскрывая каждую единицу продукции.
Таблица 1
| Количество | единиц | Объем выборки |
| продукции сырья | ||
| 1-5 | Все единицы | |
| 6-50 | 5 единиц | | |
| Свыше 50 | 10% единиц продукции. | |
| составляющих партию |
Примечание. Неполные 10 единиц продукции приравнивают к 10 единицам (например, при наличии в партии 51 единицы продукции объем выборки составляет 6 единиц).
Попавшие в выборку единицы продукции вскрывают и путем внешнего осмотра определяют однородность сырья по способу подготовки (цельное, измельченное, прессованое и т. д.). цвету, запах}', засоренности; наличие плесени, гнили, устойчивого
28постороннего запаха, не исчезающего при проветривании; засоренность ядовить растениями и посторонними примесями (камни, стекло, помет грызунов и птиц и т. д Одновременно невооруженным глазом и с помощью лупы (5—10Х) определяют налич1а амбарных вредителей.
При установлении (внешний осмотр) неоднородности сырья, наличия плесени и гнили, засоренности посторонними растениями в количествах, явно превышающих допустимые примеси и т. д. вся партия должна быть рассортирована, после чего вторично предъявлена к сдаче.
При обнаружении в сырье затхлого, устойчивого постороннего запаха, не исчезающего при проветривании, ядовитых растений и посторонних примесей (помет грызунов и птиц, стекло и др.), зараженности амбарными вредителями II и III степеней партия сырья не подлежит приемке.
Отбор проб.Из каждой единицы продукции, отобранной для вскрытия, берут, избегая измельчения, 3 точечные пробы: сверху, снизу и из середины. Из мешков, тюков и кип точечные пробы отбирают на глубине не менее 10 см рукой сверху, затем, после распарывания по шву, из середины и снизу; точечные пробы семян и сухих плодов отбирают зерновым щупом. Из сырья, упакованного в ящик, первую точечную пробу отбирают из верхнего слоя, вторую — после удаления сырья примерно до половины ящика и третью — со дна ящика. Точечные пробы должны быть примерно одинаковыми по массе. Из всех точечных проб, осторожно перемешивая, составляют объединенную пробу.
Для установления степени зараженности амбарными вредителями из объединенной пробы методом квартования выделяют пробу массой 500 г для мелких видов сырья и массой 1000 г — для крупных видов сырья. Эту пробу помещают в плотно закрывающуюся банку, в которую вкладывают этикетку.
Из объединенной пробы методом квартования выделяют среднюю пробу. Для этого сырье разравнивают на гладкой, чистой, ровной поверхности в виде квадрата по возможности тонким равномерным по толщине слоем и по диагонали делят на четыре треугольника. Два противоположных треугольника сырья удаляют, а два оставшихся соединяют вместе и перемешивают. Эту операцию повторяют до тех пор, пока не останется количество сырья в двух противоположных треугольниках, соответствующее массе средней пробы, указанной в табл. 2 ГФ XI т.1. Остатки объединенной пробы сырья присоединяют к партии. Допустимые отклонения в массе средней пробы не должны превышать ±10
Среднюю пробу упаковывают в полиэтиленовый или многослойный бумажный мешок. К мешку прикрепляют этикетку, такую же этикетку вкладывают внутрь мешка. На этикетке указывают следующие данные: наименование сырья; наименование поставщика: номер партии; массу партии: дату отбора пробы; фамилию и должность лица, отобравшего пробу.
Из средней пробы методом квартования выделяют аналитические пробы для определения:
— подлинности, измельченности и содержания примесей;
— влажности (аналитическую пробу для определения влажности отделяют сразу же после отбора средней пробы и упаковывают герметически);
— содержания золы и действующих веществ.
Примечание. Для таких видов сырья, как цельные травы, корни, корневища, клубни, после выделения аналитической пробы для определения подлинности, измельченности и содержания примесей часть средней пробы, предназначенную для определения влажности, содержания золы и действующих веществ, измельчают ножницами или секатором на крупные куски, тщательно перемешивают и затем выделяют соответствующие аналитические пробы.
Масса аналитических проб должна соответствовать указанной в табл. 3 ГФ XI т.1 с 271.
Примечание. Масса средней и аналитической проб для свежего лекарственного растительного сырья указана в соответствующей нормативно-технической документации. Если при выделении аналитических__проб в двух противоположных треугольниках масса сырья окажется меньше или больше указанной в табл. 3, следует из оставшихся двух треугольников отделить сырье по всей толщине слоя и добавить недостающую часть или таким же образом удалить его из отобранных треугольников.
Аналитические пробы должны быть взвешены с погрешностью ±:
0,01 — при массе пробы до 50 г;
0,1 — при массе пробы от 100 до 500 г;
1,0 — при массе пробы от 500 до 1000 г;
5,0 — при массе пробы более 1000 г.
При установлении в результате испытаний несоответствия качества сырья требованиям нормативно-технической документации проводят его повторную проверку. Для повторного анализа от невскрытых единиц продукции отбирают выборку в соответствии с табл. 1. Результаты повторного анализа являются окончательными и распространяются на всю партию. Примечание. Указанная статья не распространяется на правила приемки и методы отбора корня женьшеня.
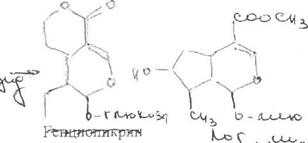
Folia Menyanthidis trifoliatae -листья вахты трехлистной
Menyanthes trifoliata L. из сем. вахтовых (Menyanthaceae); используют в качестве лекарственного сырья и лекарственного средства.
Химический состав.Основными действующими веществами листьев вахты трехлистной являются монотерпеноидные горечи: логанин, сверозид, ментиафолин; флавоноиды: рутин, гиперозиди трифолин, кроме того, они содержат небольшое количество дубильных веществ, некоторое количество йода, следы алкалоидов.
V4
Использование.Листья применяют в форме настоя и густого экстракта как повышающее
аппетит и желчегонное средство. Входят в состав желчегонных сборов и горькой настойки. Используются в гомеопатии.
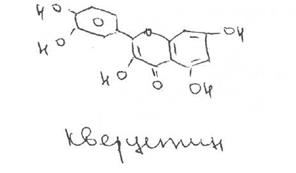
Вопрос 2. На рисунке представлена формула рутина.
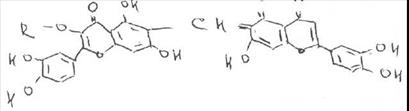
По химической структуре рутин относится к гликозидам. Сахарная часть его молекулы — дисахарид — включает D-глюкозу и L-рамнозу. Агликоном является кверцетин. который применяют в виде индивидуального лекарственного вещества с Р-витаминной активностью. Дигидрокверцетин также является агликоном.
Рутин содержится влистьях руты пахучей (Ruta graveolens L.),в почках и цветках софоры японской (Sophora japonica L.) и других растений. Наиболее богатым его источником служит зеленая масса гречихи, из которой выделяют 1,5-6% рутина. Извлекают рутин водой, затем отделяют белки осаждением, ирутин перекристаллизовывают. При получении следует учитывать, что рутин в кислой среде, особенно при нагревании, легко гидролизуетсяс образованием кверцетина, рамнозы и глюкозы.
Относится к группе флавоноидов.
Rutoside — рутозид (Рутин 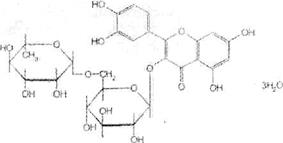
3-рутинозид кверцетина или3-рамноглюкозил-3,5,7.3',4'-пентаоксифлавон
Флавоноиды практически нерастворимы в воде и хлороформе, рутозидрастворим в кипящем этаноле. Являясь многоатомными фенолами, они растворимы в разбавленных растворах едких щелочей.
Для испытания на подлинность флавоноидов используют ИК-, УФ-спектрофотометрию, ПМР-спектроскопию. ИК-спектры флавоноидов, полученные после прессования в таблетках бромида калия в обпсти 4000-700 см' , должны полностью совпадать с полосами поглощения прилагаемых к НД рисунков спектров.
УФ-спектры поглощения растворов флавоноидов в этаноле в области 220-400 нм имеют максимумы поглощения у рутозида при 258 нм и 362,5 нм. В соответствии с требованиями ФС устанавливают величины удельных показателей поглощения этанольных растворов. У рутозида при длине волны 362,5 нм он находится в пределах от 300 до 330
Для испытаний флавоноидов используют реакцию гидролиза (рутозид). а также химические реакции, обусловленные наличием в молекулах фенольных гидроксилов, образованием халконов, перилиевых солей, комплексных соединений.
Для испытания подлинности рутозида используют цветную реакцию с раствором гидроксида натрия (желто-оранжевое окрашивание). Окраска обусловлена превращением флавоноида в халкон с раскрытием пиранового цикла:
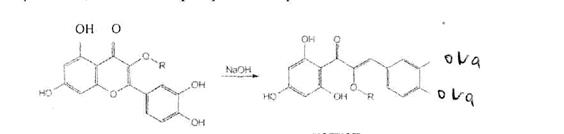
рутозид халкон
Цветная реакция происходит при действии на рутозид порошком магния и концентрированной хлороводородной кислотой в спиртовой среде (красное окрашивание). Это испытание известно под названием цианиноеой реакции. Она основана на образовании окрашенных пирилиевых солей при восстановлении водородом флавоноидов. в том числе рутозида: ОН
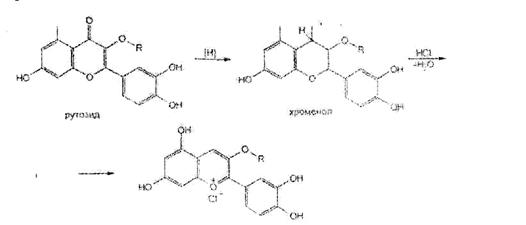
цианин хлорид (пирилиевая соль )
Наличие фенольных гидроксилов в молекуле рутозида легко установить цветной реакцией с хлоридом железа (III) (темно-зеленое окрашивание). 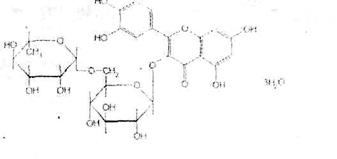
Рутозид образует комплексные соединения с солями других тяжелых металлов, например с солями свинца - выпадает оранжевый осадок .
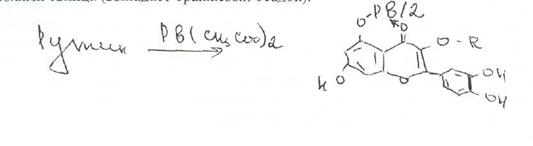
Присутствие в его молекуле фенольного гидроксила обусловливает положительную реакцию с раствором формальдегида в серной кислоте (красно-оранжевое окрашивание)
Реакцию образования^азосоединения с солью диазония (красно-бурая окраска). 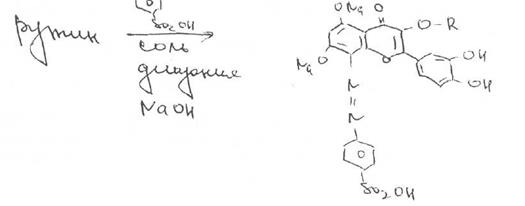
Подлинность рутозида подтверждают также путем кислотного гидролиза, который происходит в результате кипячения (с обратным холодильником) в присутствии серной кислоты. Образующийся кверцетин. перекристаллизованный из этанола, имеет температуру плавления 308 "С. Эту методику используют для гравиметрического определения рутозида.
Наличие глюкозы в молекуле рутозида обнарулсивают после гидролиза в кислой среде с помощью реактива Фелинга
Наличие фенольных гидроксилов в молекуле рутозида легко установить цветной реакцией с хлоридом железа (III) (темно-зеленое окрашивание).
Рутозид образует комплексные соединения с солями других тяжелых металлов, например
Присутствие в его молекуле фенольного гидроксила обусловливает положительную реакцию с раствором формальдегида в серной кислоте (красно-оранжевое окрашивание)
о о
Реакцию образования^азосоединения с солью диазония (красно-бурая окраска).
Подлинность рутозида подтверждают также путем кислотного гидролиза, который происходит в результате кипячения (с обратным холодильником) в присутствии серной кислоты. Образующийся кверцетин. перекристаллизованный из этанола, имеет температуру плавления 308 "С. Эту методику используют для гравиметрического определения рутозида.
Наличие глюкозы в молекуле рутозида обнарулсивают после гидролиза в кислой среде с помощью реактива Фелинга
При испытании на чистоту устанавливают наличие в рутозиде примеси кверцетина (не более 5%). Для этой цели используют УФ-спектрофотометрию или радиальную бумажную хроматофафию. Хроматофафируют в чашке Петри в 60%-ном растворе уксусной кислоты. После опрыскивания 10%-ным раствором сульфата аммония хроматофаммы сушат и просматривают в УФ-свете при 360 нм. Должно быть только одно пятно кверцетина, Устанавливают также отсутствие в рутозиде примеси алкалоидов, хлорофилла и пигментов, растворимых в эфире, а также других примесей, нерастворимых в этаноле. Они могут попасть в него из исходного растительного сырья.
Количественное определение рутозида выполняют методом УФ-спектрофотометрии. Растворителем служит абсолютный этанол для рутозида. Измерения оптической плотности растворов рутозида выполняют при 375 и 362,5 нм. а затем рассчитывают содержание по приведенным в ФС формулам.
Известны также различные способы фотометрического определения рутозида цветных реакций.
Рутозидхранят в хорошо укупоренной таре, в сухом месте, предохраняя от действия света.
Они относятся к группе капилляроукрепляющих средств. Применяют внутрь для профилактики и лечения гипо- и авитаминоза Р. а также для лечения заболеваний, связанных с нарушением проницаемости сосудов и поражений капилляров. Назначают рутозид внутрь в виде таблеток по 0.02-0,05 г 2-3 раза в сутки.
Вопрос 3. Настойки сложные
Сложные настойки приготовляются перколяционным способом, который обычно активируется применением циркуляции. Вначале приготовляют однородную смесь из измельченных частей растений, входящих в состав прописи, которую затем смачивают экстрагентом в мацерационном баке и через 3—4 ч переносят в перколятор.
Таким путем, в частности, получается Tinctura amara — горькая настойка. В ее состав входят (части по массе): трава золототысячника — 6, листья трифоли—6. корневище аира—
—3, трава полыни—3, кожура мандарина 1,5. Спирта — 40%; соотношение 19.5:100. Применяется в качестве ароматической горячи для возбуждения аппетита и улучшения пищеварения.
Настойки представляют собой окрашенные жидкие спиртовые, или водно-спиртовые извлечения из лекарственного растительного сырья, получаемые без нагревания и удаления экстрагента. Степень измельчения лекарственного растительного сырья должна быть указана в частных статьях.
Для получения настоек могут быть использованы различные способы: мацерация (настаивание), дробная мацерация, мацерация с принудительной циркуляцией экстрагента, вихревая экстракция, перколяция (вытеснение) и др.
Получение настоек_ состоит из_следующих стадий: подготовка лекарственного растительного сырья иэкстрагента, экстрагирование лекарственныхвеществ из растительного материала (растворение густых или сухих экстрактов), очистка извлечения, стандартизация готового продукта. Подготовка растительного материала заключается в подсушивании,измельчении* и освобождении от пыли. Экстрагент готовят разведением крепкого этанола водой до нужной концентрации.
При получении настоек методом мацерации растительный материал истощается неполностью, особенно, когда объем экстрагента ограничен, поэтому в настоящее время предложены различные, более совершенные его модификации. Наряду с ним часто используют метод перколяции. Растворением сухих экстрактов получают лишь отдельные настойки (например, чилибухи), растворением густого экстракта солодки— грудной эликсир.
Настойки по степени очистки являются одними из самых несовершенных препаратов. Очистка настоек заключается в отстаивании полученного извлечения в течение нескольких дней при температуре не выше 8 °С. В период отстаивания коагулируют и выпадают в осадок многие высокомолекулярные соединения, различные механические включения. Отстоявшуюся вытяжку сливают и фильтруют через друк-или пресс-фильтры, нутч-фильтрыиспользовать не следует из-за возможной потери экстрагента.
Стандартизацию настоек проводят по этанолу, содержанию действующих или экстрактивных веществ, регламентируют тяжелые металлы (не более 0,001 %)
Содержание этанола устанавливают по температуре кипения или методом дистилляции с последующим определением плотности отгона пикнометром (ГФ XI). Схема производства настоекСтадии и операции технологического процесса 1 Подготовка экстрагенга:
2. Подготовка растительного сырья
Отвешивают рассчитанное количество лекарственного растительного сырья, измельченного соответствующим образом от среднемелкого до очень крупного порошка (указания в частных статьях ГФ X) Сырье должно отвечать требованиям ГФ X. Частицы сырья должны проходить через сито с соответствующим диаметром отверстий.
3. Экстракция сырья, уровень этанола над сырьем 1-2 см. Определяют полноту истощения сырья. Измеряют объем полученной настойки.
4. Рекуперация этанола из отработанного сырья.
Проводят вытеснением водой или перегонкой с водяным паром. Измеряют объем рекуперата и определяют концентрацию этанола в нем.
5. Очистка настойки
Проводят путем отстаивания в течение нескольких суток при температуре не выше 8° С и последующего фильтрования. Должна быть прозрачной
6. Стандартизация
Стандаг£изую21п0 количественному содержанию действующих веществ, концентрации этанола или плотности и сухому остатку. Нормируется также содержание тяжелых металлов. При завышенном содержании действующих веществ настойку разбавляют экстрагентомдо нормыГФ X ст. 684, частные статьи, с. 813.
Измерение объема рекуперата и определение концентрации этанола и в нем Должна соответствовать требованиям НТД. При завышенном содержании действующих веществ ее разбавляют экстрагентом до нормы
Упаковка и оформление
7. При изготовлении настоек из одной весовой части лекарственного растительного сырья получают 5 объемных частей готового продукта, из сильнодействующего сырья—10 частей, если нет других указаний в частных статьях.
Полученные извлечения отстаивают при температуре не выше 10 °С до получения прозрачной жидкости не менее 2 сут и фильтруют.
Методы испытания.В настойках определяют: содержание действующих веществ по методикам, указанным в частных статьях; содержание спирта (ГФ XI, вып. 1, с. 26) или плотность (ГФ XI, вып. 1, с. 24), сухой остаток и тяжелые металлы.
ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ
Плотностью называют массу единицы объема вещества:
Если массу т измерить в граммах, а объем V в кубических сантиметрах, то плотность представляет собой массу 1 см вещества: р г/см .
Определение плотности проводят с помощью пикнометра или ареометра.
Методика определения. Метод I. Применяют в случае определения плотности, жидкостей с точностью до 0,001. Чистый сухой пикнометр взвешивают с точностью до 0,0002 г, заполняют с помощью маленькой воронки дистиллированной водой немного выше метки, закрывают пробкой и выдерживают в течение 20 мин в термостате, в котором поддерживают постоянную температуру воды 20°С с точностью до 0.1 °С. При этой температуре уровень воды в пикнометре доводят до метки, быстро отбирая излишек воды при помощи пипетки или свернутой в трубку полоски фильтровальной бумаги. Пикнометр снова закрывают пробкой и выдерживают в термостате еще 10 мин, проверяя положение мениска по отношению к метке. Затем пикнометр вынимают из термостата, фильтровальной бумагой вытирают внутреннюю поверхность горлышка пикнометра, а также весь пикнометр снаружи, оставляют под стеклом аналитических весов в течение 10 мин и взвешивают с той же точностью.
Пикнометр освобождают от воды, высушивают, споласкивая последовательно спиртом и эфиром (сушить пикнометр путем нагревания не допускается), удаляют остатки эфира продуванием воздуха, заполняют пикнометр испытуемой жидкостью и затем производят те же операции, что и с дистиллированной водой.
Метод 2. Применяют в случае определения плотности жидкостей с точностью до 0,01. Испытуемую жидкость помещают в цилиндр и при температуре жидкости 20°С осторожно опускают в нее чистый сухой ареометр, на шкале которого предусмотрена ожидаемая величина плотности. Ареометр не выпускают из рук до тех пор, пока не станет очевидным, что он плавает; при этом необходимо следить, чтобы ареометр не касался стенок и дна цилиндра. Отсчет производят через 3—4 мин после погружения по делению на шкале ареометра, соответствующему нижнему мениску жидкости (при отсчете глаз должен быть на уровне мениска).
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СПИРТА В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ
1. Метод дистилляции. В круглодонную колбу вместимостью 200—250 мл отмеривают точное количество жидкости. При содержании спирта в жидкости до 20% для определения берут 75 мл жидкости, если жидкость содержит от 20 до 50% — 50 мл. от 50% и выше — 25 мл; жидкость перед перегонкой разбавляют водой до 75 мл.
Для равномерного кипения в колбу с жидкостью помещают капилляры, пемзу или кусочки прокаленного фарфора. Если жидкость при перегонке сильно пенится, то добавляют фосфорную или серную кислоту (2-—3 мл), хлорид кальция, парафин или воск (2—3 г).Приемник (мерную колбу вместимостью 50 мл) помещают в сосуд с холодной водой, собирают около 48 мл отгона, доводят его температуру до 20сС . и добавляют воды до метки. Отгон должен быть прозрачным или слегка мутным.
Плотность отгона определяют пикнометром ипо алкоголеметрическим таблицам находят соответствующее содержание спирта в процентах по объему.
Определение содержания спирта в настойках проводят также по температуре кипения.
Прибор для количественного определения спирта в настойках состоит из сосуда для кипячения 1, трубки 2 с боковым отростком, холодильника 3 и ртутного термометра 4 с ценой деления 0,1°С и пределом шкалы от 50 до 100°С (рис. 4).
В сосуд для кипячения наливают 40 мл настойки и для равномерного кипения помещают капилляры, пемзу или кусочки прокаленного фарфора. Термометр помещают в приборе таким образом, чтобы ртутный шарик выступал над уровнем жидкости на 2—3 мм.
Определение сухого остатка.5 мл настойки помещают во взвешенный бюкс, выпаривают на водяной бане досуха и сушат два часа при 102,5±2,5°С. затем охлаждают в" эксикаторе 30 мин и взвешивают.
Определение тяжелых металлов. 5мл настойки выпаривают досуха, прибавляют 1 мл концентрированной серной кислоты, осторожно сжигают и прокаливают. Полученный остаток обрабатывают при нагревании 5 мл насыщенного раствора аммония ацетата, фильтруют через беззольный фильтр, промывают 5 мл воды и доводят фильтрат водой до объема 100 мл; 10 мл полученного раствора должны выдерживать испытание на тяжелые металлы (не более 0,001 %) (ГФ XI. вып. 1, с. 165).
К 10 мл раствора испытуемого препарата, приготовленного, как указано, прибавляют 1 мл разведенной уксусной кислоты. 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, состоящим из 1 мл эталонного раствора Б, такого же количества реактивов, какое прибавлено к испытуемому раствору, и 9 мл воды.
Наблюдение окраски проводят по оси пробирок диаметром около 1,5 см, помещенных на белой поверхности.
В сравниваемых растворах допустима лишь слабая опалесценция от серы, выделяющейся из сульфида натрия.
Pb2+ + S2" = PbS (черный осадок)
Хранение.В упаковке, обеспечивающей стабильность препарата в течение указанного срока годности, в прохладном, защищенном от света месте. В процессе хранения настоек возможно выпадение осадка.
Правила введения спиртосодержащих препаратов в условиях аптеки: спиртосодержащие препараты в микстуры вводят в последнюю очередь в порядке увеличения конц-ции небольшими порциями для предупреждения выпадения в осадок водорастворимых в-в.
Вопрос 4. Рецепт выписан правильно.
Срок действия рецепта - 2 мес. Рецепт отдается больному с указание на обороте количества отпущенного препарата и даты отпуска и не хранится в аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не действителен».
Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности, а для ЛС, взаимодействующих с пищей, времени их употребления относительно приема пищи (до. во время, после еды).
Условия хранения в аптеке: Готовые средства укладываются в упаковке этикеткой наружу. На шкафы и полки прикрепляется стеллажная карта, в которой отражены наименование лекарства, серия и срок годности.Такая карта заводится на каждую вновь поступившую серию, что позволяет осуществл, контроль своевременной ее реализации.
В отделе должна находиться картотека по срокам годности препаратов.
Лекарственные средства с истекшим сроком годности хранятся отдельно и подлежат переконтролю (после получения результатов анализа).
Таблетки и драже необходимо хранить отдельно от других средств в заводской упаковке в сухом и при необходимости в защищенном от света месте.
Инъекционные препараты хранят в прохладном темном месте в шкафу или изолированном помещении.
Жидкие лекарственные формы (настойки, сиропы и др.) хранят в герметичной таре, наполненной доверху, в темном и прохладном месте. При выпадении осадка настойку можно отфильтровать. Она считается пригодной к применению после проверки ее качества.
Лекарственное растительное сырье хранят в сухом, хорошо вентилируемом помещении § хорошо закрытой таре.
Резаное сырье должно находиться в тканевых мешках, порошки - в двойных мешках (многослойный бумажный — внутренний, тканевый — наружный), в картонных упаковках. Иногда допускается упаковка из полимерных материалов.
Растительное лекарственное сырье периодически контролируют согласно требованиям Государственной фармакологии.
Если сырье поражается плесенью, вредителями или теряет нормальную окраску и запах, его или бракуют, или (после переработки) используют.
ПРИКАЗ МИНЗДРАВА РФ ОТ 04.03 2003~N 80 (С ИЗМ. ОТ 30 01 2004) "ОБ УТВЕРЖДЕНИИ ОТРАСЛЕВОГО СТАНДАРТА "ПРАВИЛА ОТПУСКА (РЕАЛИЗАЦИИ) ЛЕКАРСТВЕННЫХ С (приказ должен быть на экзамене).
В аптечной организации в удобных для ознакомления местах торгового зала должны быть размещены:
- копии лицензий на фармацевтическую деятельность и другие виды деятельности в соответствии с действующим законодательством Российской Федерации;
информация о телефонах и адресах органов управления здравоохранением и фармацевтической деятельностью;
- книга отзывов и предложений;
- информация о группах населения, имеющих право на бесплатное и льготное обеспечение внеочередное обслуживание, в соответствии с действующим законодательством Российской Федерации;
- информация о лице, ответственном за лекарственное обеспечение инвалидов Великой Отечественной войны и приравненных к ним категорий населения по льготам (для аптечных организаций, осуществляющих льготный отпуск лекарственных препаратов);
- информация о номерах телефонов и режиме работы справочной фармацевтической службы;
- информация о наименованиях отделов или зон отпуска соответствующих групп товаров;
- информация о сроках хранения лекарственных препаратов, изготовленных в аптеке (аптечном пункте)]
- ценники на предлагаемые безрецептурные лекарственные препараты и другие товары, разрешенные отпуску из аптечных организаций;
информация о сотрудниках аптечной организации. непосредственно обслуживающих население (таблички, бейджи и прочие с указанием ФИО и должности);
- информация о дежурном администраторе (ФИО, должность) и нахождении кнопки сигнального вызова дежурного администратора (за исключением аптечного киоска);
- при наличии пункта проката, информация о перечне предметов, выдаваемых на прокат:
- копия или выписка из Федерального закона "О защите прав потребителей"
Лицензирование в сфере обращения лекарственных средствВ любой стране с целью обеспечения качества лекарственных препаратов и оказания фармацевтической помощи создаются системы взаимодействующих органов, центров и организаций, выполняющих определенные функции, среди которых немаловажное значение имеет функция лицензирования. В частности, ВОЗ создана и функционирует Система сертификации лекарственных препаратов для международной торговли, в соответствии с которой осуществляется лицензирование лекарственных препаратов, производителей и оптовиков.
Для государственного регулирования и контроля за отдельными приоритетными видами деятельности в России предусмотрена специальная норма права, которая называется лицензированием, введенная в процессе рыночных преобразований в начале 90-х гг. XX в. Эта норма права способствует защите свобод, прав, законных интересов, нравственности и здоровья граждан, обеспечению обороны страны и безопасности государства.
Лицензируемый вид деятельности — это деятельность, на осуществление которой на территории РФ требуется получение лицензии.
Основным критерием отнесения к лицензируемым видам деятельности является возможность нанесения в результате осуществления данной деятельности ущерба правам, законным интересам, здоровью граждан, обороне и безопасности государства, культурному наследию народов РФ, а также то, что их регулирование не может осуществляться иными методами, кроме как лицензированием.
Правовая основа лицензирования. Правовой основой лицензирования фармацевтической деятельности являются федеральные законы, постановления Правительства РФ, приказы Министерства здравоохранения Российской Федерации и другие правовые акты.
Вопросы лицензирования затрагиваются в нескольких статьях Федерального закона «О лекарственных средствах». В ст. 15 «Лицензирование производства лекарственных средств» определены лицензионные требования на производство ЛС. перечень необходимых документов, сроки и условия получения лицензии. В ст. 17 «Изготовление лекарственных средств» указывается на необходимость получения лицензии на осуществление фармацевтической деятельности, в частности на изготовление ЛС. В ст. 23 «Лицензирование внешнеторговой деятельности» определена необходимость получения лицензии на внешнеторговую деятельность предприятиями-изготовителями и предприятиями оптовой торговли. Лицензия выдается федеральными органами исполнительной власти. На основании данной лицензии осуществляется ввоз и вывоз лекарственных препаратов. В ст. 30 «Лицензирование оптовой торговли лекарственными средствами» определена необходимость лицензирования, установлены территориальные ограничения на действие лицензии. Федеральные лицензии действуют на всей территории РФ, а лицензии, выданные территориальным органом исполнительной власти, действуют на территории данного региона. В той же статье указано на необходимость разработки Правил оптовой торговли ЛС. В ст. 34 «Лицензирование фармацевтической деятельности аптечных учреждений» установлено, что лицензия на розничную реализацию ЛС выдается органами исполнительной власти субъектов Федерации, дан перечень документов, необходимых для ее получения.
Для регулирования отношений, возникающих между федеральными органами исполнительной власти, органами исполнительной власти субъектов РФ, юридическими лицами и индивидуальными предпринимателями в связи с осуществлением лицензирования отдельных видов деятельности, принят специальный Федеральный закон «О лицензировании отдельных видов деятельности».
Под лицензированием понимаются мероприятия, связанные с выдачей лицензий, переоформлением документов, подтверждающих наличие лицензий, приостановлением и аннулированием лицензий и контролем лицензирующих органов за соблюдением лицензиатами при осуществлении лицензируемых видов деятельности соответствующих лицензионных требований и условий.Все существующие виды деятельности с точки зрения лицензирования можно разделить на три группы: 1) деятельность, не требующая лицензирования: 2) деятельность, требующая специального лицензирования; 3) деятельность, лицензирование которой проводится в соответствии с Федеральным законом «О лицензировании отдельных видов деятельности».
К первой группе можно отнести оказание некоторых фармацевтических услуг, например ■ доставку лекарств на дом. Культивирование лекарственных растений, проведение научных исследований в области изыскания, создания, получения, разработки технологии некоторых ЛС (кроме наркотических средств и психотропных веществ) также не требуют лицензирования.
Ко второй группе относятся виды деятельности, лицензирование которых осуществляется в соответствии со специальными нормативными документами и па которые действие Федерального закона о «Лицензировании отдельных видов деятельности» не распространяется. Например, деятельность в области производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции; деятельность в области таможенного дела; страховая деятельность; осуществление внешнеэкономических операций; использование результатов интеллектуальной деятельности; использование природных ресурсов, в том числе недр, лесного фонда, объектов растительного и животного мира, образовательная деятельность и др. В данном случае Правительством РФ принимаются специальные законы о лицензировании. Так, принят Федеральный закон от 07.01.99 № ] 8-ФЗ «О государственном регулировании производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции».
К третьей группе относятся виды деятельности, на которые распространяется действующий Федеральный закон «О лицензировании отдельных видов деятельности» и которые перечислены в соответствующей статье. В последнем принятом законе значительно сокращено количество лицензируемых видов деятельности, в настоящее время их названо 116против 250, определенных предыдущим документом.
Принципы лицензирования.Основными законодательно утвержденными принципами осуществления лицензирования в РФ являются:
обеспечение единства экономического пространства на территории РФ;
установление единого перечня лицензируемых видов деятельности;
установление единого порядка лицензирования на территории РФ;
установление лицензионных требований и условий положениями о лицензировании конкретных видов деятельности;
гласность и открытость лицензирования:
соблюдение законности при осуществлении лицензирования.
Единство экономического пространства. В целях обеспечения единства экономического пространства на территории РФ правительство утверждает Положения о лицензировании конкретных видов деятельности, определяет федеральные органы исполнительной власти, осуществляющие лицензирование конкретных видов деятельности, устанавливает виды деятельности, лицензирование которых осуществляется органами исполнительной власти субъектов Федерации.
В принятом Федеральном законе «О лицензировании отдельных видов деятельности» даются общие нормы права, единые для всех видов деятельности, регулируемых данным законом. Таким образом, для учета особенностей лицензируемых видов деятельности Правительством РФ специальными постановлениями утверждаются Положения о лицензировании конкретных видов деятельности. Любое изменение в федеральном законодательстве должно сопровождаться приведением в соответствие с ним всех подзаконных актов. Так, в связи с выходом в 2001 г. Федерального закона, регулирующего процесс лицензирования, началась работа по приведению существующих положений в соответствие с новым законом. В настоящее время приняты постановления Правительства РФ: «Об утверждении Положения о лицензировании фармацевтической деятельности» от 01.07.2002 № 489, «О лицензировании деятельности, связанной с оборотом наркотическихсредств и психотропных веществ» от 21.06.2002 № 454, «Об утверждении Положения о лицензировании деятельности по культивированию растений, используемых для производства наркотических средств и психотропных веществ» от 14.06.2002 № 423, «Об утверждении Положения о лицензировании производства лекарственных средств» от 04.07.2002 № 500, «Об утверждении Положения о лицензировании медицинской деятельности» от 04.07.2002 № 499 и др.
Единый перечень лицензируемых видов деятельности. Он устанавливается Федеральным законом, где в соответствующей статье перечислены подпадающие под его действие виды деятельности (в Федеральном законе «О лицензировании отдельных видов деятельности» — это ст. 17). Среди перечисленных видов деятельности так или иначе связаны с деятельностью субъектов фармацевтического рынка следующие: фармацевтическая деятельность; производство ЛС; производство медицинской техники; деятельность по распространению ЛС и ИМН; культивирование растений, используемых для производства наркотических средств и психотропных веществ; деятельность, связанная с оборотом наркотических средств и психотропных веществ (разработка, производство, изготовление, переработка, хранение, перевозки, отпуск, реализация, распределение, приобретение, использование, уничтожение), внесенных в Список II в соответствии с Федеральным законом «О наркотических средствах и психотропных веществах»; деятельность, связанная с оборотом наркотических средств и психотропных веществ (разработка, производство, изготовление, переработка, хранение, перевозки, отпуск, реализация, распределение, приобретение, использование, уничтожение), внесенных в Список Ш в соответствии с Федеральным законом «О наркотических средствах и психотропных веществах»; деятельность, связанная с использованием возбудителей инфекционных заболеваний; производство дезинфекционных, дезинсекционных, дератизационных средств; аудиторская деятельность; деятельность по изготовлению и ремонту средств измерений; ветеринарная деятельность; медицинская деятельность и др.
Как уже упоминалось, для учета особенностей каждого конкретного вида деятельности разрабатываются специальные положения, которые утверждаются постановлениями Правительства РФ. Аналогичные положения могут быть утверждены в субъектах РФ. которые представляют региональный уровень управления и которым дано право определять порядок лицензирования на своей территории в соответствии с местными условиями. Например, в Москве распоряжением мэра утверждено Временное положение о порядке лицензирования фармацевтической деятельности на территории города Москвы, которое разработано с учетом федеральных правовых документов, специальным приказом Комитета здравоохранения Правительства Москвы № 369 от 20.08.2001 утверждено Положение о лицензировании медицинской и фармацевтической деятельности в городе Москве, определяющее порядок получения лицензии в столице.
Единый порядок лицензирования. Он обусловлен:
едиными правами и полномочиями, предоставленными лицензирующим органам;
требованиями, предъявляемыми к соискателям лицензий и лицензиатам;
процедурой лицензирования.
К лицензирующим органам в России относятся федеральные органы исполнительной власти и органы исполнительной власти субъектов РФ. которые осуществляют лицензирование в соответствии с действующим законом.
Билет 4
 Вопрос 1. На рисунке представлена формула атропина сульфата. —Atropine Sulfate —атропина сульфат
Вопрос 1. На рисунке представлена формула атропина сульфата. —Atropine Sulfate —атропина сульфат
тропинового эфира сЦ-троповой кислоты сульфат
Белый кристаллический или слегка комкующийся порошок без запаха. Т. пл.
атропина сульфата 188-194 °С
Т. пл. основания атропина 115-117°. Угол вращения не более -0,6° (5%-ный водный
раствор в трубке длиной 2 дм)
Соли тропановых алкалоидов и их синтетических аналогов легко растворимы в воде (атропина сульфат
— очень легко), легко растворимы в этаноле. В хлороформе атропина сульфат практически нерастворим, '
Известны спектрофотометрические методики идентификации атропина сульфата в максимумах поглощения при длинах волн 252, 258 и 264 нм (растворитель вода). Количественное спектрофотометрическое определение с достаточной точностью выполнить в УФ-области не представляется возможным, так как удельный показатель поглощения в этих условиях очень низкий (от 4,13 до 5,41).
Методом ВЭЖХ на жидкостном хроматографе «Милихром» разработаны способы идентификации и определения производных тропана в лекарственных формах. Предложена унифицированная методика, основанная на использовании времени удерживания, коэффициента емкости и других факторов.
Испытания алкалоидов, производных тропана и их синтетических аналогов осуществляют также с помощью химических реакций: гидролиза, нитрования, окисления, сложной эфирной группы

Для испытания подлинности и количественного определения производных тропана использован метод ГЖХ. Качественную оценку осуществляют по относительным объемам удерживания и индексам удерживания Ковача. При выполнении количественного определения используют внутренний стандарт.
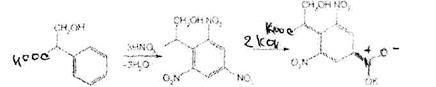
Реакция основана на их гидролизе, нитровании и окислении выделившихся кислот (при выпаривании с концентрированной азотной кислотой). При действии на остаток после выпаривания спиртовым раствором гидроксида калия и ацетона происходит образование окрашенного в фиолетовый цвет соединения хиноидной структуры. Схема реакции на примере троповой кислоты:
Общее испытание заключается в осаждении органических оснований из растворов действием гидроксидов щелочных металлов. Эту реакцию используют для установления подлинности атропина сульфата, основания которых имеют характерную температуру плавления.
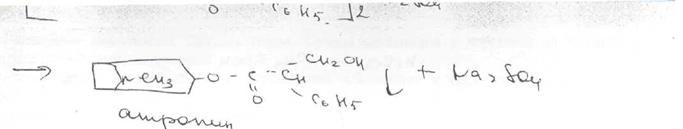
Производные тропана можно также идентифицировать осадительными (общеалкалоидными) реактивами: раствором пикриновой кислоты, раствором иода, реактивами Марки, Драгендорфа и др. ^__

При нагревании основания атропина с раствором серной кислоты в присутствии кристалла дихромата калия ощущается запах горького миндаля вследствие образования бензальдегида:
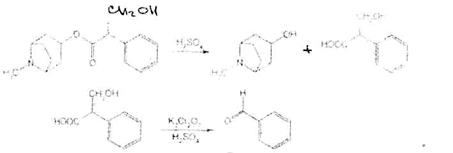
бензальдегид
При испытании на чистоту устанавливают допустимые пределы примесей посторонних алкалоидов. Это вызвано тем, что исходный продукт синтеза — тропин получают обычно гидролизом смеси алкалоидов, производных тропана. Допустимо содержание апоатропина в атропина сульфате (не более 0.2%),. Этипосторонние алкалоиды обладают восстанавливающими свойствами (обесцвечивают раствор перманганата калия) вследствие наличия в молекуле непредельной связи:
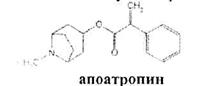
Указанные примеси определяют также методом ТСХ на пластинках Силуфол УФ-254.
Количественное определение производных тропана выполняют методом неводногонитрования. Титруют в среде безводной уксусной кислоты 0,1 М раствором хлорной кислоты 'индикатор кристаллический фиолетовый).
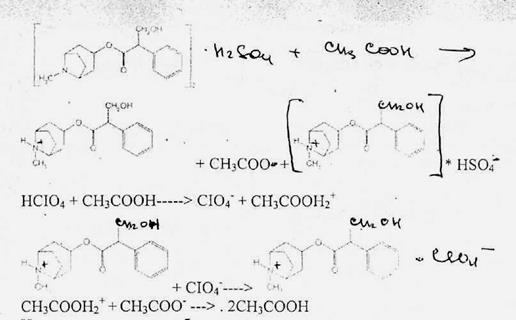
Известны также спосооы определения производных тропана методом нейтрализации в водно-спиртов
Дата добавления: 2015-08-04; просмотров: 13072;
