Кислотно-основные свойства
Спирты являются амфотерными соединениями. Они способны выступать в роли как кислот, так и оснований.
Диссоциацией по связи О-Н, спирты проявляют себя как типичные кислоты Бренстеда:
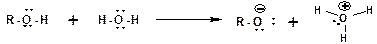
Соответственно спирты способны взаимодействовать со щелочными и щелочноземельными металлами (магний) с замещением атома водорода гидроксильной группы на катион металла. При этом выделяется водород (в момент выделения «in sity» атомарный и поэтому очень активный) и образуется алкоголят:
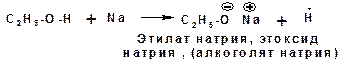
Алкоголяты легко гидролизуются:
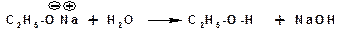
Кислотные свойства спиртов понижаются в ряду метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп, понижающих стабильность аниона.
Свойства оснований спирты проявляют по отношению как к кислотам Бренстеда, так и к кислотам Льюиса. Донорным атомом в молекуле спирта является атом кислорода. Кислоты Бренстеда протонируют атом кислорода гидроксильной группы:
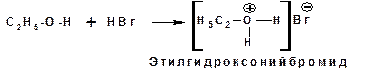
Кислоты Льюиса образуют со спиртами донорно-акцепторные комплексы, в которых атом кислорода выступает в роли донора неподеленной электронной пары:
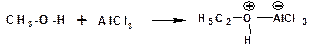
Спирты являются слабыми основаниями. Основные свойства возрастают в ряду: метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп.
Дата добавления: 2015-08-01; просмотров: 848;
