ОСОБЕННОСТИ ТВЕРДОГО СОСТОЯНИЯ ВЕЩЕСТВА
6.1. Структура твердых тел. @
В отличие от жидкостей твердые тела обладают упругостью формы. Если к твердому телу приложить внешнюю силу, то возможно изменение его формы. После снятия нагрузки тело примет первоначальный вид, если не перейден некоторый предельный уровень деформации. Наличие упругой деформации у твердых тел и отсутствие ее у жидкостей обусловлены различием в их молекулярном строении и характере теплового движения молекул. Твердые тела делятся на два типа, существенно отличающихся друг от друга по физическим свойствам: кристаллические и аморфные.
Подавляющее большинство твердых тел в природе имеет кристаллическое строение. Они характеризуются упорядоченностью расположения составляющих их частиц, наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Частицы, из которых построены кристаллы, совершают малые колебания около положения равновесия. Структура, для которой характерно регулярное расположение частиц, с периодической повторяемостью в 3-х измерениях, называется кристаллической решеткой. Средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
Различают монокристаллы и поликристаллы. У первых частицы образуют единую кристаллическую решетку, всюду одинакового типа. Это большинство минералов, лед, поваренная соль. Однако условия роста кристаллов в природных условиях часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, состоящую из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами – это многие горные породы, металлы и их сплавы.
 Характерная черта монокристаллов заключается в наличии анизотропии, т. е. зависимости ряда физических свойств( механических, электрических, оптических) от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки, т.е. плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристаллов вдоль этих направлений (рис.6.1). Поликристаллы изотропны, т.е. их свойства одинаковы по всем направлениям.
Характерная черта монокристаллов заключается в наличии анизотропии, т. е. зависимости ряда физических свойств( механических, электрических, оптических) от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки, т.е. плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристаллов вдоль этих направлений (рис.6.1). Поликристаллы изотропны, т.е. их свойства одинаковы по всем направлениям.
Аморфные тела всегда изотропны, для них характерен ближний порядок в расположении частиц и отсутствие кристаллической решетки.
6. 2. Физические типы кристаллических решеток. @
В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от характера сил взаимодействия между ними различают 4 типа кристаллов:
1. Ионные кристаллы. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия между ними являются, в основном, электростатическими. Связь, обусловленная данными силами, называется ионной. Типичным примером является поваренная соль NaCl. Образующая молекулу группировка из иона Na и иона хлора Cl утрачивает в кристалле обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
2. Атомные кристаллы. В узлах кристаллической решетки помещаются нейтральные атомы. Связь, их объединяющая, называется ковалентной. Силы взаимодействия при этой связи также имеет электрический (но не кулоновский характер). Объяснение этих сил может быть дано только на основе квантовой механики. Ковалентная связь осуществляется электронными парами, т.е. в обеспечении связи участвует по одному электрону от каждого атома, причем эта связь осуществляется только валентными электронами. Поскольку каждый электрон может обеспечить связь только с одним атомом, число связей, в которых может участвовать данный атом (число соседей, с которыми он может быть связан), равно его валентности. Типичными примерами атомных кристаллов могут служить алмаз и графит.
3. Металлические кристаллы. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решетки и не могут ее покинуть.
4. Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле называют ван-дер-ваальсовскими, они имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. Обычный лед, а также так называемый сухой лед (твердая углекислота) представляют собой молекулярные кристаллы.
6. 3. Теплоемкость кристаллов. @
Расположение частиц в узлах кристаллической решетки отвечает минимуму их взаимной потенциальной энергии. При смещении частиц из положения равновесия в любом направлении появляется сила, стремящаяся вернуть частицу в первоначальное положение, вследствие чего возникают колебания частицы. Этот колебательный характер движения сохраняется вплоть до температуры плавления. Колебание вдоль произвольного направления можно представить как наложение колебаний вдоль трех взаимно перпендикулярных направлений. Поэтому каждой частице в кристалле следует приписывать три колебательные степени свободы, на каждую из которых, по закону Больцмана, приходится энергия kТ. Следовательно, на каждую частицу в кристалле приходится в среднем энергия, равная 3kT. В случае химически простых веществ, когда число частиц в одном моле вещества есть NA, внутренняя энергия одного моля вещества
Um = 3 NAkT = 3RT, откуда dUm /dT = 3R
Приращение внутренней энергии, соответствующее повышению температуры на один градус, равно согласно определенной ранее теплоемкости при постоянном объеме:
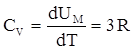 |
Поскольку объем твердых тел при нагревании меняется мало, их CР мало отличается от Cv, так что можно говорить просто о теплоемкости твердого тела. Итак, получается, что молярная теплоемкость химически простых тел в кристаллическом состоянии одинакова и равна 3R. Это утверждение есть закон Дюлонга и Пти, установленный эмпирическим путем. Если твердое тело является химическим соединением (например NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n – число атомов в молекуле. Таким образом, молярная теплоемкость твердых химических соединений
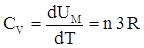 |
Закон выполняется с довольно хорошим приближением для многих веществ при комнатной температуре, хотя некоторые элементы (С, Ве, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, существует зависимость теплоемкости кристаллов от температуры. Эти расхождения удалось объяснить только с помощью квантовой теории теплоемкостей.
 6.4. Плавление и кристаллизация. @
6.4. Плавление и кристаллизация. @
Переход кристаллического тела в жидкое состояние – это фазовое превращение. Оно происходит при определенной для каждого вещества температуре и требует затраты некоторого количества тепла, называемого теплотой плавления. Если твердое тело нагревать, то его внутренняя энергия, которая складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц, возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится – кристалл плавится. Зависимость температуры тела Т от количества теплоты Q, получаемой телом при плавлении, изображена на рис.6.2. По мере сообщения телу теплоты его температура повышается, а при Т=Тпл начинается переход тела из твердого состояния в жидкое. Температура Тпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться.
 Если жидкость охлаждать, то процесс пойдет в обратном направлении. (рис.6.3). Здесь Q – количество теплоты, отдаваемое телом при кристаллизации. Вначале температура жидкости понижается, затем при постоянной температуре, равной Тпл, начинается кристаллизация, после ее завершения температура кристалла начнет понижаться. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации – кристаллических зародышей, которыми могут служить различные примеси, пыль, сажа. Если жидкость тщательно очистить от таких частиц, ее можно охладить ниже температуры кристаллизации без образования кристалликов. Состояние такой переохлажденной жидкости является метастабильным. Обычно достаточно попасть в такую жидкость пылинке, для того, чтобы она распалась на жидкость и кристаллы, находящиеся при равновесной температуре. В некоторых случаях при больших переохлаждениях подвижность молекул жидкости оказывается столь незначительной, что метастабильное состояние может сохраняться очень долго. Жидкость в таких случаях обладает весьма малой текучестью и представляет собой аморфное твердое тело.
Если жидкость охлаждать, то процесс пойдет в обратном направлении. (рис.6.3). Здесь Q – количество теплоты, отдаваемое телом при кристаллизации. Вначале температура жидкости понижается, затем при постоянной температуре, равной Тпл, начинается кристаллизация, после ее завершения температура кристалла начнет понижаться. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации – кристаллических зародышей, которыми могут служить различные примеси, пыль, сажа. Если жидкость тщательно очистить от таких частиц, ее можно охладить ниже температуры кристаллизации без образования кристалликов. Состояние такой переохлажденной жидкости является метастабильным. Обычно достаточно попасть в такую жидкость пылинке, для того, чтобы она распалась на жидкость и кристаллы, находящиеся при равновесной температуре. В некоторых случаях при больших переохлаждениях подвижность молекул жидкости оказывается столь незначительной, что метастабильное состояние может сохраняться очень долго. Жидкость в таких случаях обладает весьма малой текучестью и представляет собой аморфное твердое тело.
Дата добавления: 2015-08-01; просмотров: 2268;
