Испарением называют процесс перехода вещества из жидкого в парообразное состояние, проходящий при любых температурах с открытой поверхности жидкости.
Так же как и диффузия, испарение происходит по причине непрерывного хаотического движения молекул жидкости. Средняя кинетическая энергия молекул жидкости зависит от её температуры: чем выше температура, тем энергия больше. Если какая- либо молекула верхнего слоя жидкости приобретает кинетическую энергию, большую, чем средняя кинетическая энергия молекул, то она может преодолеть силы молекулярного притяжения и вылететь из жидкости. Молекулы, вылетевшие из жидкости, образуют пар. Таким образом, жидкость покидают наиболее «быстрые» молекулы, вследствие чего средняя кинетическая энергия оставшихся молекул уменьшается, что ведёт к понижению температуры жидкости. В результате хаотического движения над поверхностью жидкости молекула пара после столкновения с другими молекулами может снова вернуться в жидкость; таким образом, одновременно с испарением происходит обратный процесс- конденсация. Опытным путем установлено, что скорость испарения зависит от ряда факторов:
а) с повышением температуры скорость испарения увеличивается;
б) если образовавшийся пар сдувается потоком воздуха или откачивается, то скорость испарения возрастает;
в) при увеличении площади свободной поверхности жидкости данного объема испарение происходит быстрее.
Если жидкость находится в открытом сосуде, то молекул испаряется больше, чем конденсируется, и масса жидкости уменьшается. Представим, что жидкость находится в замкнутом сосуде, из которого откачали воздух. Вначале число молекул, вылетевших из жидкости, растет, но чем больше число молекул пара, тем больше молекул конденсируется. В том случае, когда число молекул пара все же увеличивается, пар, находящийся над жидкостью, называют ненасыщенным. Если за одно и то же время число вылетевших из жидкости и возвратившихся в неё молекул одинаково, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называется динамическим равновесием пара и жидкости;пар, находящийся в динамическом равновесии с жидкостью, называют насыщенным.
Чем дальше состояние пара от насыщения, тем лучше он подчиняется газовым законам, например закону Клапейрона - Менделеева. Насыщенные пары не подчиняются газовым законам. Например, уменьшение объёма пара не приводит к повышению давления, а вызывает конденсацию части пара. С увеличением числа молекул пара над поверхностью жидкости при неизменной температуре его давление увеличивается. Оно достигает максимального значения, когда пар становится насыщенным. Давление насыщенного пара определяется концентрацией (число молекул в единице объёма) молекул пара и температурой.
Частным случаем испарения является кипение. Парообразование, которое происходит в объёме всей жидкости и при постоянной температуре, называется кипением.
С увеличением температуры растворимость газа, содержащегося в некотором количестве любой жидкости, уменьшается. Газ выделяется из жидкости, оседая в виде мелких пузырьков на внутренних стенках сосуда; эти пузырьки в дальнейшем служат центрами парообразования. Когда температура жидкости выравнивается, объём всплывающих пузырьков при подъёме будет возрастать, так как давление насыщенного пара внутри пузырька остаётся постоянным и равным pн =n·k·T, а гидростатическое давление 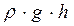 уменьшается. Когда пузырёк достигает поверхности жидкости, то давление насыщенного пара в нем практически равно давлению на поверхности жидкости. Насыщенный пар, заполняющий пузырек, выбрасывается, происходит кипение.
уменьшается. Когда пузырёк достигает поверхности жидкости, то давление насыщенного пара в нем практически равно давлению на поверхности жидкости. Насыщенный пар, заполняющий пузырек, выбрасывается, происходит кипение.
Дата добавления: 2015-08-01; просмотров: 1876;
