Уравнение состояния
В состоянии равновесия давление жидкости (или газа) p меняется с изменением ее плотности ρ и температуры T. Оно однозначно определяется значениями этих параметров. Соотношение
p=f(ρ,T)
между давлением, плотностью и температурой в состоянии равновесия называется уравнением состояния.
Для капельных жидкостей уравнения состояния очень сложны и поэтому в большинстве гидравлических расчетов принимают его в предельно простой форме
ρ = соnst, (11.1)
(т.е. плотность капельных жидкостей имеет постоянное значение).
Для газов (воздух, природный газ, перегретый пар) уравнение состояния при относительно небольших температурах и давлениях принимает такую форму
pV=RT, (11.2)
где p – абсолютное давление; Т – термодинамическая температура, К; V-удельный объем, связанный с плотностью соотношением V=1/ρ; R – универсальная газовая постоянная: для воздуха R = 287 Дж/(кг.К).
Уравнение состояния может быть записано в виде (с учетом V=1/ρ)
p/ρ=RT. (11.3)
Это уравнение позволяет определить плотность газа при данном давлении и известной температуре. Зная уравнение состояния, возможно определить фактически все основные параметры и характеристики жидкой среды. В частности, для газов коэффициент объемного сжатия определяется при Т= соnst , а коэффициент температурного расширения при p= соnst.
Имея в виду уравнение состояния идеального газа, можно описать процессы изменения его состояния.
1.Изотермический процесс. В этом случае температура газа не меняется, т.е. Т=const на протяжении всего процесса, тогда
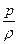 = RT = const.
= RT = const.
Изотермический процесс возможен лишь при идеально хорошем обмене теплом между газом и внешними телами.
2.Адиабатический процесс– происходящий без обмена теплом с окружающими телами.
Уравнение адиабаты
pVk = const
или
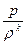 = const.
= const.
Последнее уравнение часто представляют в виде
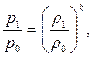
где k – коэффициент адиабаты.
3. Политропный процесс.Изотермический и адиабатический процессы являются идеальными, которые на практике осуществить нельзя, к ним можно только приблизиться. Изотермический процесс должен происходить бесконечно медленно, адиабатический процесс может протекать с конечной скоростью, но в адиабатной, теплонепроницаемой оболочке.
В природе происходят реальные процессы, являющиеся промежуточными между адиабатическими и изотермическими. Такие процессы называются политропными. Чтобы определить такой процесс, необходимо наложить на него только одно ограничение: считать, что повышение температуры тела пропорционально сообщенному телу количеству тепла ∆Q или, что то же, теплоемкость тела при политропном процессе постоянна, т.е.
∆Q = с ·∆T,
где с – const.
Для политропных процессов справедливы те же формулы, что и для адиабатических, например
 = const,
= const,
где γ имеет значение, промежуточное между сp/cv и единицей.
Задача 11.1.Определить коэффициент объемного сжатия для газов в изотермическом процессе (Т= соnst).
Решение. Имея в виду определение коэффициента βр в виде (8.1) и уравнение состояния (11.2) находим dW/dp (в данном случае через W обозначаем объем во всех зависимостях). Из (11.2), W=RT/p, при Т=соnst ,
dW/dp=(-RT/p2)
и окончательно
βр=1/p(при T=const).
Задача 11.2.Определить значение коэффициента температурного расширения для газов в изобарном процессе (при р= соnst).
Задача 11.3. По трубе подается воздух, его температура t = 15°C, давление по манометру, присоединенному к трубе в некотором сечении равно PM=39 кПа. Атмосферное давление pат = 735 мм рт.ст. Определить плотность воздуха в данном сечении.
Решение. Определим плотность воздуха с помощью уравнения состояния (11.3)
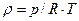 .
.
Давление p в числителе складывается из атмосферного давления pат = 735 мм рт.ст. = 97960,8 Па и избыточного pМ = 39000 Па = 39 кПа. Результирующее давление p равно p = 136960,8 Па. Плотность воздуха определится так
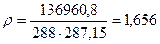 кг/м3.
кг/м3.
Дата добавления: 2015-08-01; просмотров: 1199;
