Физические свойства. Галогенметаны, за исключением йодметана, являются газами
Галогенметаны, за исключением йодметана, являются газами. Их низшие гомологи представляют собой бесцветные высоколетучие жидкости со сладковатым запахом.
Рост атомного номера галогена ведет к росту температуры кипения галегеналкана.
Рост температуры кипения наблюдается при увеличении числа атомов галогена в молекуле галогеналкана. Следует отметить, что фторпроизводные не подчиняются этим закономерностям. Так температура кипения дихлорметана (хлористый метилен, метиленхлорид) СН2Cl2 - 400С, а температура кипения дифтордихлорметана СF2Cl2 - -280С. Свойство фторметанов иметь аномальные температуры кипения – явилось причиной применения фторметанов в качестве фреонов – холодильных жидкостей.
| Элемент | Фтор | Хлор | Бром | Йод | Углерод (sp3) |
| Электроотрицательность | 4.0 | 3.0 | 2.8 | 2.5 | 2.5 |
Как видно из таблицы атомы галогенов, кроме йода имеют электроотрицательность более высокую, чем у атома углерода в состоянии sp3-гибридизации.
| Элемент | Энергия, кДж/моль | Длина, нм | Дипольный момент, D | Рефракция, см3 | Потенциал ионизации, эВ. |
| Фтор | 447.7 | 0.141 | 1.81 | 1.44 | - |
| Хлор | 278.2 | 0.176 | 1.83 | 6.51 | 11.29 |
| Бром | 225.9 | 0.191 | 1.79 | 9.38 | 10.53 |
| Йод | 194.5 | 0.210 | 1.60 | 14.61 | 9.5 |
Соответственно ковалентные связи Сsp3-Наl полярны (С sp3 – J в наименьшей степени.). Характеристики связей приведены в таблице.
Дипольный момент(μ ) = величина электрического заряда (q) × расстояние между зарядами(r). В системе СИ размерность дипольного момента – дебай (D)
Данные таблицы показывают, что галогены обладают отрицательным индуктивным эффектом, а в молекулах галогеналканов электронная пара связи Сsp3-Наl смещена в сторону атома галоида:

Кроме того, данные таблицы показывают, что снижение полярности связи сопряжено со снижением энергии связи и ростом ее поляризуемости.
Все эти особенности связи Сsp3-Наl свидетельствуют в пользу предположения о том, что связь Сsp3-Наl должна подвергаться гетеролитическому разрыву. Причем в ряду от фтора к йоду разрыв должен происходить с убывающими затратами энергии т.е. все легче. В результате разрыва отрицательным зарядом будет обладать атом галоида, а на атоме углерода возникнет положительный заряд, т.е. образуется карбкатион:
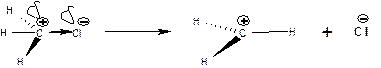
Образующийся карбкатион, частица, несущая положительный заряд, будет взаимодействовать с частицами, несущими отрицательный заряд. Таковыми являются нуклеофилы. Соответственно для галогенопроизводных со связью С(sp3)-Наl характерны реакции нуклеофильного замещения (SN) и элиминирования (Е).
Дата добавления: 2015-08-01; просмотров: 1109;
