Основы термодинамики
Важной характеристикой термодинамической системы является ее внутренняя энергия U – энергия хаотического (теплового) движения микрочастиц (молекул, атомов, электронов, ядер) и энергия взаимодействия этих частиц. К ней не относится кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях. При переходе системы из одного состояния в другое изменение внутренней энергии этих состояний ∆U=U2 – U1. Введем понятие числа степеней свободы i – числа независимых переменных (координат), определяющих положение системы в пространстве.
Молекулу одноатомного газа можно рассматривать как материальную точку, которой приписывают три степени свободы поступательного движения. Двухатомная молекула кроме трех степеней свободы имеет еще две степени свободы вращательного движения, вокруг оси, проходящей через центры атомов.
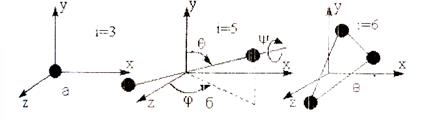
Рис.22. Степени свободы: а – одноатомной молекулы;
б – двухатомной молекулы; в – трех- и многоатомной молекулы.
Трех и многоатомные молекулы имеют 6 степеней свободы – три поступательного движения и три вращательного. Для реальных молекул следует учитывать степень свободы колебательного движения. Три степени поступательного движения, и ни одна из них не имеет преимуществ перед другими. Поэтому на каждую степень свободы приходится одинаковая энергия, равная 1/3 <E0>
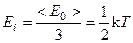
Закон Больцмана о равномерном распределении энергии по степеням свободы: для статистической системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия 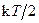 , а на каждую колебательную – kТ. На колебательную степень свободы приходится кинетическая и потенциальная энергии.
, а на каждую колебательную – kТ. На колебательную степень свободы приходится кинетическая и потенциальная энергии.
Таким образом, энергия молекулы 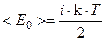
Внутренняя энергия одного моля равна 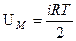
Для массы газа m 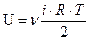 , где
, где 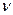 – число молей (количество вещества).
– число молей (количество вещества).
Дата добавления: 2015-08-01; просмотров: 689;
