СВОЙСТВА РАСТВОРОВ. ОСМОС. УПРУГОСТЬ ПАРА
В результате процесса растворения изменениям подвергаются свойства не только растворяемого вещества, но и самого растворителя. Применительно к разбавленным растворам эти изменения могут быть разбиты на два типа: зависящие от природы растворяемого вещества и от нее практически не зависящие. Первые, обусловленные образованием сольватов, выражаются в изменении цветности, объема и т.д. и специфичны для каждой пары растворитель – растворяемое вещество. Основной причиной вторых является уменьшение концентрации свободных молекул самого растворителя при распределении в нем другого вещества.
Одним из явлений связанных с изменением концентрации свободных молекул растворителя является осмос. Это явление имеет место, когда в соприкосновение приходят два раствора разной концентрации, отделенные друг от друга полунепроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующие прохождению частиц растворенного вещества. Сущность осмоса заключается в самопроизвольно протекающем необратимом переходе растворителя из одной части такой системы в другую.
В единице объема более крепкого раствора содержится молекул растворителя меньше, чем в таком же объеме менее крепкого раствора. В силу этого растворитель будет переходить через полунепроницаемую перегородку из раствора с меньшей концентрацией в раствор с большей его концентрацией. Осмос прекратиться, когда по обе стороны полунепроницаемой перегородки в единице объема будет содержаться одинаковое число молекул растворителя.
Количественно охарактеризовать осмотические свойства раствора (по отношению к чистому растворителю) можно вводя понятие об осмотическом давлении. Под последним понимается то внешнее давление, которое необходимо приложить к данному раствору, чтобы осмос прекратился. Осмотическое давление водного раствора можно определить с помощью осмометра (определяется высотой столба жидкости = h).
На основании сходства свойств разряженных газов и разбавленных растворов голландский физико-химик Вант-Гофф вывел уравнение осмотического давления
P = C ∙R ∙T
где Р – осмотическое давление
С – концентрация растворенного вещества в молях к единице объема
R – универсальная газовая постоянная
Т – абсолютная температура
Другим важным следствием уменьшения концентрации свободных молекул растворителя при образовании раствора является понижение давления его пара.
Жидкость находится в равновесии со своим паром тогда, когда число молекул, испаряющихся с ее поверхности, равно числу молекул, оседающих на нее из газообразной фазы. Так как часть поверхности раствора занята сольватированными молекулами нелетучего растворенного вещества, то соответственно уменьшается испаряющееся с нее за единицу времени число молекул растворителя. Поэтому равновесное состояние в случае раствора устанавливается на более низком уровне, чем в случае чистого растворителя, т.е. упругость пара над раствором будет меньше.
Французский электрохимик Рауль установил, что относительное понижение давления насыщенного пара над раствором равно молярной доле растворенного вещества.
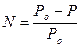
где Ро – давление насыщенного пара растворителя над чистым растворителем
Р – давление насыщенного пара растворителя над раствором
N – молярная доля растворенного вещества в растворе
Если величины давления пара чистой воды и раствора при разных температурах изобразить в виде диаграммы, то кривая для раствора пройдет ниже, чем кривая для воды. Из этого вытекают важные следствия, касающиеся температур кипения и замерзания.
Жидкость закипает тогда, когда давление пара становится равным внешнему давлению, т.е. при нормальных условиях – 760 мм рт. ст. Для раствора это равенство достигается при более высокой температуре, чем для чистого растворителя. Величина такого повышения точки кипения зависит от концентрации раствора.
С другой стороны, жидкость замерзает тогда, когда давление ее пара становится равным давлению пара соответствующей твердой фазы. Давление пара льда достигается для раствора при более низкой температуре, чем для чистой воды. Отсюда следует, что растворы замерзают при более низких температурах, чем чистый растворитель и величина понижения точки замерзания как и в первом случае зависит от концентрации раствора (вода океана, содержащая 3,5% растворенных солей, замерзает при –1,9 оС).
Для одномоляльных растворов повышение температуры кипения носит название эбулиоскопической константы, понижение температуры замерзания – криоскопической константы соответствующего растворителя. Эти величины для различных растворителей очень различны. Вода характеризуется наименьшими значениями обеих констант. (+ 0,51 и –1,86 градус соответственно).
Дата добавления: 2015-07-30; просмотров: 981;
