СТЕПЕНЬ И КОНСТАНТА ДИССОЦИАЦИИ
Количественную характеристику равновесного состояния электролита дает его степень диссоциации (α) и константа диссоциации (К). Степень диссоциации численно равна отношению числа молекул, распавшихся на ионы к общему числу растворенных молекул. Это отношение часто умножают на 100 и, таким образом, выражают диссоциированную часть в процентах от общего числа молекул.
Говоря о степени диссоциации электролитов, необходимо указывать, о какой концентрации растворов идет речь, т.к. изменение концентрации раствора (разбавление) различно сказывается на процессах диссоциации и моляризации.
На диссоциацию существенно влияют лишь непосредственно окружающие молекулу частицы воды. Они имеются в достатке как в разбавленных, так и в концентрированных растворах. Поэтому разбавление существенно не сказывается на скорости диссоциации. Скорость моляризации при этом заметно уменьшается, т.к. она зависит от числа столкновений между разноименными ионами. При разбавлении число столкновений уменьшается, равновесие смещается, степень диссоциации будет увеличиваться.
При работе с растворами электролитов удобно пользоваться нормальными концентрациями. При одинаковой нормальности различные электролиты диссоциируют весьма различно. Для определения и сопоставления степеней диссоциации на практике используют 0,1 н растворы. Электролиты, диссоциирующие в этих условиях на 30% и более, называют сильными; диссоциированные в пределах от5 до 30% - электролитами средней силы; менее 5% - слабыми.
Определенные опытным путем степени диссоциации для сильных электролитов не являются истинными величинами, они не отвечают действительным степеням распада молекул на ионы (степени диссоциации для сильных электролитов, определенные опытным путем называют кажущимися). Подобное несоответствие обусловлено наличием электростатического взаимодействия ионов друг с другом, которое существенно проявляется в растворах сильных электролитов. Свойства этих растворов (сильных электролитов) зависят не от концентрации растворенных веществ и, следовательно, не от концентрации ионов, а от других величин, которые называются активностями.
Активность (а) иона равна его концентрации, умноженной на коэффициент активности:
а = f ∙ c
Коэффициент активности является величиной, суммарно отражающей все имеющие место в растворе электростатические взаимодействия между ионами. В большинстве случаев коэффициенты активности меньше 1.
Мерой электростатического взаимодействия ионов в растворе является ионная сила, которая определяется уравнением:
I = 1/2∑сi ∙ zi2
где zi - заряд иона;
сi – молярная концентрация этого иона.
Для слабых электролитов взаимодействие ионов друг с другом невелико и кажущиеся степени диссоциации практически совпадают с истинными.
КОНСТАНТА ДИССОЦИАЦИИ. Другой важной характеристикой равновесного состояния электролита является его константа диссоциации К. В качестве примера найдем константу диссоциации реакции, записанной в общем виде:
АВ → А+ + В-
Согласно закону действующих масс (скорость химической реакции пропорциональна действующим массам реагирующих веществ. Действующая масса – молярная концентрация реагирующих веществ) скорость прямой реакции (диссоциации) определяется уравнением:
V1 = К1 ∙ [АВ]
где К1 – коэффициент пропорциональности, который называется константой скорости прямой реакции
[АВ] – молярная концентрация молекул АВ
Скорость обратной реакции (моляризации) запишем в виде:
V = К1 ∙ [А+] ∙ [В–]
К2 – константа скорости обратной реакции
[А+] и [В–] – молярные концентрации ионов А и В
В состоянии химического равновесия
V1 = V2 , следовательно K1[АВ] = К2[А+] [В-] или
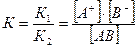
К – является критерием силы электролитов: К≥10-2 - сильные; К = 10-2 - 10-4 - средней силы; слабые электролиты - 10-5 - 10-9.
С изменением концентрации (разбавлением) константа диссоциации не меняется, поэтому она дает более общую характеристику электролита, чем степень диссоциации. Это верно лишь для слабых электролитов, растворы которых содержат немного свободных ионов. У сильных электролитов начинает заметно сказываться наличие электростатического взаимодействия ионов друг с другом, результатом чего является отклонение от закона действия масс и изменение величины К при разбавлении. Поэтому, как и степень диссоциации для растворов сильных электролитов константа диссоциации является величиной кажущейся.
Дата добавления: 2015-07-30; просмотров: 1644;
