Номенклатура координационных соединений
Первым в именительном падеже называется анион, а затем в родительном падеже- катион. В названии комплексного иона сначала перечисляются лиганды, далее центральный ион. Число лигандов указывается греческими числительными- ди, три, тетра, пента, гекса и т.д. К латинскому названию лигандов добавляют окончание «о»: Cl-- хлоро; NO2- - нитро и тд.
Примеры:
[Cu(NH3)4]Cl2 - хлорид тетрамминмеди (II);
[Pt(NH3)3NO2Cl]SO4 - сульфат хлоронитротриамминплатины (IV);
[PtCl4(NH3)2] - диаминтетрахлороплатина.
За некоторыми координационными соединениями сохранились исторически сложившиеся названия: K3[Fe(CN)6] – красная кровяная соль; K4[Fe(CN)6] – желтая кровяная соль и др.
Лигандами могут быть нейтральные молекулы или анионы кислот:
1) нейтральные H2O, NH3, CO, этилендиамин- Н2N-CH2-CH2-NH2 и др.
2) анионы: Cl-, OH-, CN-, F-, оксалат-ион- С2O42- и др.
Заряд внутренней сферы складывается из заряда катиона металла и суммы зарядов лигандов: [Ag(CN)2]-, [Pt(Cl)6]2-, [Fe(CN)6]4-.
Лиганды могут быть монодентатными и полидентатными. Монодентатные лиганды связаны с центральным атомом металла только одной связью, а полидентатные- несколькими, например:
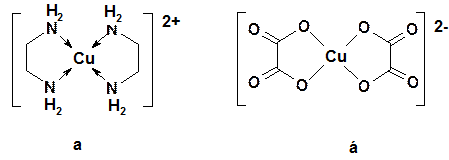
Простой линией обозначается внутрикомплексная химическая связь, образованная между катионом металла и отрицательно заряженным анионным лигандом (б), а стрелочкой – донорно-акцепторная связь между катионом металла и электронейтральным лигандом (а).
Важнейшим параметром комплексообразователя и всего координационного соединения является координационное число (к.ч.), которое наряду со степенью окисления в комплексных соединениях служит еще одной его характеристикой.
Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» – зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин, другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют полидентатными: NH2–CH2–CH2–NH2 – этилендиамин, NH2–CH2–COO– – глицинат.
Координационные соединения с бидентатными лигандами, образующие металлоциклы, как указано выше, часто называют хелатными.
Так, в комплексах металлов с диметилглиоксимом реализуются хелатные металлоциклы, например, в комплексе никеля(II):
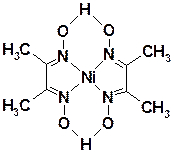
Здесь точками обозначены внутримолекулярные водородные связи. Этот плоский (квадратный) комплекс - бис(диметилглиоксимато)никель(II), представляет собой малорастворимое в воде соединение красного цвета; применяется для определения никеля(II).
Прочность таких соединений как правило выше, чем с монодентатными лигандами с аналогичными донорными группами. Этот эффект усиления прочности связывания бидентатными лигандами называют хелатным эффектом (от англ. Сhelate – клешня) .
Хелатный эффект- это частный случай общей закономерности усиления прочности связывания ионов металла при увеличении степени его обхвата лигандом.
Например для лигандов:

Дата добавления: 2015-07-30; просмотров: 1231;
