Квантовая физика атома
|
4.37.Уравнение Шредингера для стационарных состояний электрона, находящегося в атоме водорода, задается в декартовых координатах уравнением 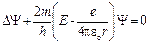 .
.
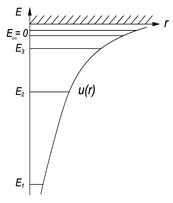
Представить 1) собственные значения энергии, удовлетворяющие уравнению; 2) график потенциальной энергии взаимодействия электрона с ядром; 3) возможные дискретные значения энергии на этом графике. [1) 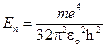 ,
,  =1, 2, 3,…
=1, 2, 3,…
2), 3) см. рисунок справа].
4.38.От каких квантовых чисел зависят соответственно радиальная 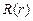 и сферическая
и сферическая 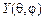 функции, входящие в волновую функцию связанных состояний атома водорода? [
функции, входящие в волновую функцию связанных состояний атома водорода? [ 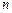 ,
, 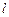 ;
; 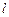 ,
, 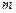 ].
].
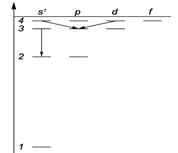
| 4.39.На рисунке слева схематически представлена система энергетических уровней атома водорода. Какие переходы запрещены правилами отбора? [3s→2s]. |
4.40.Пользуясь условными обозначениями состояний электрона в атоме водорода, записать переходы, приводящие к возникновению серии Бальмера.[ns→2p; nd→2p] (n = 3, 4, …).
|
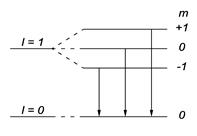
4.41.Объяснить диаграмму, иллюстрирующую расщепление энергетических уровней и спектральных линий (с учетом правил отбора) при переходах между состояниями с 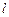 = 1 и
= 1 и 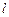 = 2. [p – состояние:
= 2. [p – состояние: 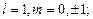 s – состояние:
s – состояние: 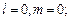
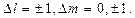 ].
].
4.42.Нормированная волновая функция, описывающая
1s – состояние электрона в атоме водорода, имеет вид 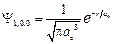 , где
, где 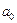 – первый боровский радиус. Определить среднюю потенциальную энергию электрона в поле ядра. [
– первый боровский радиус. Определить среднюю потенциальную энергию электрона в поле ядра. [ 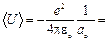 – 27,2 эВ].
– 27,2 эВ].
4.43.Определить, во сколько раз орбитальный момент импульса электрона, находящегося в d – состоянии, больше, чем для электрона в p – состоянии. [1,73].
4.44.Записать электронную конфигурацию атома фосфора с вакансией в 2p – подоболочке. [1s2 2s2 2p5 3s2 3p3].
4.45.Записать квантовые числа, определяющие внешний, или валентный, электрон в основном состоянии атома алюминия. [ 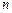 = 3,
= 3, 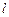 = 1,
= 1, 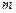 = 0, ±1;
= 0, ±1; 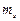 = ±1/2].
= ±1/2].
Дата добавления: 2015-07-30; просмотров: 1484;
