БОРОВСКАЯ ТЕОРИЯ АТОМА ВОДОРОДА
В 1913 году Н.Бор (датский физик), используя представления о квантовом характере излучения и поглощения, предпринял попытку создать качественно новую теорию атома, которая связала бы воедино эмпирические закономерности линейчатых спектров и устойчивость атомов (в рамках планетарной модели атома).
В основу своей теории Бор положил два постулата (утверждения, не имеющих логического обоснования), которые отражали наиболее общие закономерности, экспериментально установленные в атомных спектрах.
Первый постулат: существуют стационарные состояния атома, соответствующие дискретному набору разрешенных значений его энергии Wi. ( i =1,2,3 …). Этим состояниям соответствует набор устойчивых электронных орбит, движение по которым не сопровождается электромагнитным излучением.
Этот постулат Бор дополнил следующим квантовым условием: из всех электронных орбит, возможных по классической теории, допустимы лишь те, для которых величина момента импульса Le электрона квантована (кратна постоянной Планка), то есть

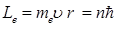 . (2.4)
. (2.4)
Второй постулат: при переходе электрона из одного стационарного состояния в другое излучается (или поглощается) один фотон с энергией
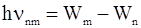 , (2.5)
, (2.5)
равной разности энергий этих состояний.
При Wn < Wm происходит излучение фотона (переход электрона с более удаленной от ядра орбиты на более близлежащую); при Wn>Wm - поглощение фотона (переход в состояние с большей энергией, т.е. на более удаленную от ядра орбиту).
Набор возможных дискретных частот квантовых переходов
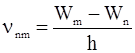 (2.6)
(2.6)
и определяет линейчатый спектр атома.
Выдвинутые Бором постулаты, позволили рассчитать спектр атома водорода и водородоподобных атомов (систем, состоящих из ядра с зарядом Z|e| и одного электрона – например, ионов He+, Li++), а также вычислить теоретически постоянную Ридберга.
Решая совместно уравнение (2.3), предложенное Резерфордом, и уравнение (2.4), получим выражение для радиуса n -ой стационарной орбиты:
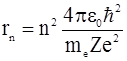 , (n=1,2,3...). (2.7)
, (n=1,2,3...). (2.7)
Для атома водорода (Z =1) радиус первой орбиты электрона (n=1) равен r1=0,528· 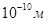 , что соответствует расчетам на основе кинетической теории газов.
, что соответствует расчетам на основе кинетической теории газов.
Полная энергия электрона в водородоподобной системе при допущении неподвижности ядра равна сумме кинетической энергии электрона ( 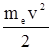 ) и потенциальной энергии его взаимодействия с ядром (
) и потенциальной энергии его взаимодействия с ядром ( 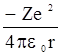 ). Учитывая соотношения (2.3) и (2.7), получим
). Учитывая соотношения (2.3) и (2.7), получим
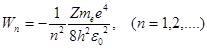 , (2.8)
, (2.8)
где знак минус означает, что электрон связан в атоме силой притяжения к ядру. Формула (2.8) показывает, что энергия электрона в атоме водорода квантована – она может принимать не любые значения, а лишь определенный набор дискретных значений, определяемый квантовым числом n.
Энергетические состояния атома образуют последовательность энергетических уровней. С ростом n энергетические уровни сближаются. Абсолютное значение Wn в формуле (2.8) считают равным энергии связи электрона в атоме, находящемся в
n-ом состоянии. Энергетическое состояние, соответствующее n=1, называется основным (нормальным) состоянием. Все состояния с n > 1 являются для атома водорода возбужденными. Минимальная энергия атома водорода равна W1= – 13,55 эВ ( n>1), максимальная W¥=0 (n = ¥), что соответствует ионизации атома (отрыву от него электрона). Энергия ионизации невозбужденного атома водорода равна
Wi=W¥ - W1 =13,55 эВ.
В соответствии со вторым постулатом Бора, при переходе атома водорода (Z =1) из стационарного состояния m в стационарное состояние n с меньшей энергией испускается квант излучения частотой
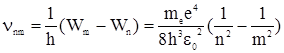
(2.9)
где 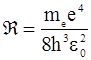 - постоянная Ридберга. (2.10)
- постоянная Ридберга. (2.10)
Значение 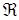 , рассчитанное по формуле (2.10), совпадает с ее экспериментальным значением. Это совпадение доказывает правильность полученной Бором формулы (2.8).
, рассчитанное по формуле (2.10), совпадает с ее экспериментальным значением. Это совпадение доказывает правильность полученной Бором формулы (2.8).
Таким образом, теория Бора позволила впервые объяснить наблюдаемые спектры простейших атомов и другие явления, в которых проявляются квантовые закономерности.
Дата добавления: 2015-07-24; просмотров: 1887;
