СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Химическая кинетика – это раздел химии, в котором изучают влияние различных факторов на скорость химической реакции и ее механизм. Рассматриваются только реакции, которые термодинамически разрешены (DGхр< 0).
Скоростью химической реакции называют изменение концентрации реагирующих веществ или продуктов реакции (DС) в единицу времени V = 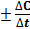
 . Скорость реакции измеряется в моль/л∙с, если она идет во всем объеме системы (гомогенная реакция) и в моль/м2∙с, если реакция идет на границе раздела фаз (гетерогенная реакция). Гомогенная система состоит из одной фазы, гетерогенная – из нескольких фаз. Фазойсистемы называют ее часть, отделенную от других физической границей и обладающую во всех своих частях одинаковым составом и свойствами.
. Скорость реакции измеряется в моль/л∙с, если она идет во всем объеме системы (гомогенная реакция) и в моль/м2∙с, если реакция идет на границе раздела фаз (гетерогенная реакция). Гомогенная система состоит из одной фазы, гетерогенная – из нескольких фаз. Фазойсистемы называют ее часть, отделенную от других физической границей и обладающую во всех своих частях одинаковым составом и свойствами.
Средняя скорость реакции Vср. в интервале времени от t1 до t2 определяется соотношением
V = 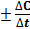 , где DС = С2 - С1 , Dt = t2 - t1; С1 и С2 – молярная (моль/л) концентрация любого участника реакции в моменты времени t1 и t2 соответственно. Знак (-) перед дробью относится к изменению концентраций исходных веществ, DС< 0; знак (+) - к изменению концентраций продуктов реакции, DС > 0.
, где DС = С2 - С1 , Dt = t2 - t1; С1 и С2 – молярная (моль/л) концентрация любого участника реакции в моменты времени t1 и t2 соответственно. Знак (-) перед дробью относится к изменению концентраций исходных веществ, DС< 0; знак (+) - к изменению концентраций продуктов реакции, DС > 0.
Мгновенная скорость – это скорость реакции в момент времени t. Она определяется производной от концентрации по времени Vt = 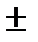
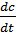 (моль/л∙с, моль/л∙час).
(моль/л∙с, моль/л∙час).
Скорость реакции aA + bB → cC + dD экспериментально можно определять либо по убыли концентраций исходных веществ, либо по увеличению концентраций продуктов реакции:
Vt = 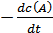 =
= 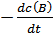 =
= 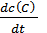 =
= 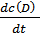
Под механизмом химической реакции понимают последовательность отдельных стадий процесса, приводящих к продуктам реакции. Стадия, имеющая наименьшую скорость, называется лимитирующей. Она определяет скорость процесса в целом.
Основными факторами, влияющими на скорость химической реакции, являются: а) природа реагирующих веществ; б) концентрация реагирующих веществ; в) давление (если в реакции участвуют газы); г) температура; д) наличие катализатора; ж) площадь поверхности раздела фаз (для гетерогенных реакций).
Дата добавления: 2015-07-24; просмотров: 874;
