Фазовая диаграмма однокомпонентной системы
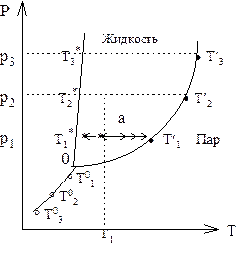 Рис. 8 - 1.Фазовая диаграмма
однокомпонентной системы
(нормальная система).
Рис. 8 - 1.Фазовая диаграмма
однокомпонентной системы
(нормальная система).
|
Для построения фазовой диаграммы однокомпонентной системы проведем серию следующих экспериментов.
Чистое жидкое вещество, взятое при постоянном давлении Р1 и начальной температуре Т1 (им соответствует точка а на рис. 8 - 1), начнем нагревать. Температура жидкости будет постепенно возрастать (направление повышения температуры показано обычными стрелками), и при температуре Т`1 жидкость закипит (точка кипения отмечена крестиком) . Состоянию кипения отвечает равновесие между паром и жидкостью, т.е. сосуществуют две фазы. После испарения всей жидкости дальнейшее нагревание приводит к возрастанию температуры пара (при более строгом использовании терминологии при давлении Р1 и температуре выше Т`1 вещество в газовой фазе должно считаться газом, а не паром). Взяв жидкость при давлениях Р2, Р3 ..., найдем точки кипения, которым соответствуют температуры Т`2,Т`3 ... Линия с этими точками характеризует равновесие жидкость - пар.
Если изменить температуру или давление, при котором равновесно сосуществуют жидкость и пар, то необходимо изменять и другой параметр. В окрестностях точек, находящихся левее или правее линии жидкость - пар, можно независимо изменять оба параметра, оставаясь в пределах одной фазы: левее линии - в жидкой фазе, а правее линии - в газовой фазе. Следовательно, при двух переменных внешних параметрах (давление и температура) в однокомпонентной системе, содержащей одну фазу, существуют две независимых переменных или, согласно принятой терминологии, две степени свободы (система бивариантна), а двухфазная система имеет только одну степень свободы (независимо можно изменять один параметр, а функция второго параметра от первого представлена линией жидкость - пар).
Сопоставим полученный результат с правилом фаз Гиббса.
Для рассматриваемой системы r=2 и K=1. Так как в однофазной области Ф=1, а в двухфазной области Ф=2, то в первом случае применение правила фаз Гиббса дает
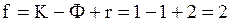 ,
,
а во втором -
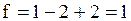 .
.
Продолжая эксперименты, будем охлаждать жидкость при постоянном давлении Р1 (направление понижения температуры на рис.8 - 1 показано стрелками со звездочками).
При температуре Т1* начнется кристаллизация жидкости. После того, как в твердое вещество превратится последняя часть жидкости, в системе, состоящей только из твердого вещества, понижение температуры продолжится.
Для давлений Р2, Р3, ... температуры кристаллизации окажутся равными Т2*, Т3*, ... Соединяя точки с этими координатами, получим сплошную линию, правее которой система состоит только из жидкой фазы, а левее - только из твердой фазы. Точки на линии отвечают равновесному сосуществованию твердого вещества и жидкости. Система в этих точках имеет одну степень свободы.
Понижением давления можно систему из твердого состояния перевести в газообразное. Испарение твердого вещества происходит при температурах То1,То2,То3 и т.д. Соединяя эти точки, получим еще одну линию, разделяющую области пара и твердого вещества. Над линией располагается область однофазной системы (твердое вещество), под линией также находится область однофазной системы (пар). В точках на линии содержатся две фазы (равновесно сосуществующие твердое вещество и пар).
Три линии сходятся в одной точке О, которая называется тройной точкой . В тройной точке система нонвариантна, так как она содержит одновременно три равновесно сосуществующие фазы.
Наклон линий на плоской диаграмме однокомпонентной системы определяется по уравнению Клапейрона - Клаузиуса.
Отметим, что теплота испарения жидкости DНev. меньше ее теплоты возгонки DHsub.(с хорошим приближением можно считать, что теплота возгонки равна сумме теплот плавления и испарения). Поэтому линия равновесия твердое вещество - пар имеет большую крутизну, чем линия жидкость - пар.
На ход линий, определяющих равновесие жидкость - пар и твердое вещество - пар, молярный объем жидкости или твердого вещества практически не оказывает влияния, так как объем конденсированной фазы пренебрежимо мал по сравнению с объемом пара. Крутизна линии твердое вещество - жидкость, наоборот, зависит от молярных объемов жидкости и твердого вещества. Так как различие между ними очень мало, то крутизна этой линии велика. В качестве иллюстрации изложенного в табл. 8 - 1 приводятся данные по изменению молярного объема некоторых веществ при стандартном давлении.
Таблица 8 - 1.
Изменение молярного объема некоторых
веществ при плавлении
(давление 1,01325×105 Па)
| Вещество | Формула | Температура плавления, К | Изменение объема, м3/моль |
| Анилин | C6H5NH2 | 266,6 | 7,95×10-6 |
| Вода | Н2О | -1б2×10-6 | |
| Бензол | С6Н6 | 278,5 | 10,29×10-6 |
| Фенол | С6Н5ОН | 5,34×10-6 |
В таблице обращает на себя внимание знак минус для изменения объема воды. В отличие от большинства веществ, для которых характерно увеличение объема системы при плавлении, вода проявляет аномальные свойства: ее объем при плавлении уменьшается. Следовательно, линия равновесия лед - жидкая вода имеет наклон влево (рис. 8 - 2).
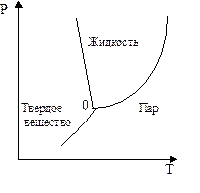 Рис. 8 - 2. Фазовая диаграмма для аномальной системы.
Рис. 8 - 2. Фазовая диаграмма для аномальной системы.
|
Дата добавления: 2015-07-24; просмотров: 1920;
