Общий принцип смещения равновесия
Для узкого температурного интервала интегрирование уравнения можно проводить, полагая, что стандартная теплота реакции DНо не зависит от температуры. Результатом такого интегрирования уравнения изобары Вант-Гоффа является
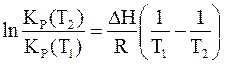 . (7 - 49)
. (7 - 49)
Несложный анализ уравнения (7 - 49) показывает, что для эндотермической реакции, идущей с поглощением теплоты системой (DH>0), повышение температуры приводит к увеличению константы равновесия и повышению содержания в системе веществ, образование которых связано с тепловыми затратами. В случае экзотермической реакции, наоборот, с повышением температуры равновесие смещается в сторону исходных веществ.
Равновесие в реакции
N2 + 3H2 = 2NH3
при повышении давления смещается в сторону образования продуктов реакции, а в реакции
2NO2 = 2NO + O2
при повышении давления равновесие смещается в сторону исходных веществ.
Рассмотренные примеры влияния температуры или давления на изменение положения равновесия являются частными случаями общей закономерности, установленной в конце 80-ых годов XIX в. Ле Шателье и Брауном.
Принцип Ле Шателье - Брауна можно сформулировать следующим образом:
При действии фактора, выводящего систему из равновесного состояния, возникают процессы, уменьшающие влияние этого фактора.
Назовем выведение системы из равновесного состояния возмущением. В соответствии с принципом Ле Шателье - Брауна система как бы сопротивляется действию возмущающего фактора, выводящего систему из равновесия ( в рассматриваемых случаях - изменения температуры или давления).
Принцип Ле Шателье - Брауна, сформулированный вначале как интуитивно установленная закономерность, получил обоснование на основе второго постулата термодинамики.
Как уже указывалось, равновесному состоянию системы отвечает равенство сродства нулю:
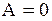 .
.
При небольшом возмущении системы вариация сродства составит dА и выполняется равенство
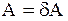 ,
,
следовательно, должно соблюдаться условие
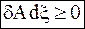 . (7 - 50)
. (7 - 50)
Выражение (7 - 50) следует из уравнений (7 - 3), (7 - 3b) и др., а именно: dG = -Adx при Р,Т = const; dF = -Adx при V,T = const и т.д.
Случай равенства в выражении (7 - 50) при любом значении dx означает равновесие в системе, а неравенство определяет область применимости принципа Ле Шателье - Брауна.
Неприменимость принципа Ле Шателье - Брауна может быть вызвана переходом системы из менее устойчивого (метастабильного) состояния к более устойчивому. В частности, принцип Ле Шателье - Брауна не применяется к процессам, протекающим со взрывом.
Принцип Ле Шателье - Брауна не приводит к каким-либо количественным результатам. Однако он оказывается весьма полезным для оценки тенденций изменений в системе при изменении как внешних параметров, так и состава системы.
Дата добавления: 2015-07-24; просмотров: 854;
