Зарядовое и массовое числа
Количество протонов Z, входящих в состав ядра, определяет его заряд q = +Ze .Число Z называется зарядовым числом ядра или атомным номером (определяет порядковый номер химического элемента в Периодической системе Менделеева).
Поскольку атом нейтрален, то заряд ядра определяет число электронов в атоме и конфигурацию электронных оболочек, а значит и свойства химического элемента. Суммарное число протонов и нейтронов в ядре, то есть число нуклонов, называется массовым числом А. Величина А данного ядра очень близка к атомной массе самого атома. Число нейтронов в ядре равно N = A - Z .
Для обозначения конкретного ядра используется символ атома с указанием А (вверху) и Z (внизу). Ядра с одинаковыми Z, но с разными А, т.е. с разным числом нейтронов, называются изотопами. Например, водород имеет три изотопа:
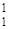 Н - обычный водород, или протий (Z=1, N=0),
Н - обычный водород, или протий (Z=1, N=0),
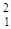 Н - тяжелый водород, или дейтерий (Z=1, N=1),
Н - тяжелый водород, или дейтерий (Z=1, N=1),
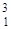 Н - тритий ( Z =1, N = 2) - радиоактивный изотоп.
Н - тритий ( Z =1, N = 2) - радиоактивный изотоп.
У кислорода три стабильных изотопа: 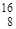 О,
О, 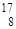 О,
О, 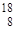 О; у олова - десять и т.д. Шкала атомных масс основана на массе изотопа
О; у олова - десять и т.д. Шкала атомных масс основана на массе изотопа 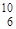 С. 1 а.е.м. (атомная единица массы равны
С. 1 а.е.м. (атомная единица массы равны 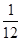 mс =931, 44 МэВ. Ядра с одинаковым массовым числом А, но разными Z - изобары:
mс =931, 44 МэВ. Ядра с одинаковым массовым числом А, но разными Z - изобары: 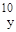 Be,
Be, 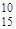 B,
B, 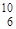 C. Ядра с одинаковым числом нейтронов N - изотоны.
C. Ядра с одинаковым числом нейтронов N - изотоны.
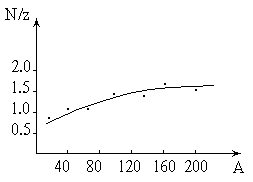 В настоящее время известно более двух тысяч ядер, отличающихся либо Z , либо А, либо тем и другим. Около четверти этих ядер устойчивы, остальные - радиоактивны. Многие ядра были получены искусственным путем. Для устойчивых ядер характерно определенное отношение числа нейтронов к числу протонов (N / Z). У легких ядер это отношение близко к единице. По мере увеличения атомного номера N / Z растет, достигая для урана Рис. 1.1.
В настоящее время известно более двух тысяч ядер, отличающихся либо Z , либо А, либо тем и другим. Около четверти этих ядер устойчивы, остальные - радиоактивны. Многие ядра были получены искусственным путем. Для устойчивых ядер характерно определенное отношение числа нейтронов к числу протонов (N / Z). У легких ядер это отношение близко к единице. По мере увеличения атомного номера N / Z растет, достигая для урана Рис. 1.1.
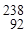 U значения приблизительно 1.6 (см. рис. 1.1).
U значения приблизительно 1.6 (см. рис. 1.1).
Дата добавления: 2015-07-24; просмотров: 2345;
